已知反应mX(g)+nY(g) qZ(g)的△H<0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法正确的是( )
qZ(g)的△H<0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法正确的是( )
| A.通入稀有气体使压强增大,平衡将正向移动 |
| B.X的正反应速率是Y的逆反应速率的m/n倍 |
| C.降低温度,混合气体的平均相对分子质量变小 |
| D.增加X的物质的量, Y的转化率降低 |
O3也是一种很好的消毒剂,具有高效、洁净、方便、经济等优点。O3可溶于水,在水中易分解,产生的[O]为游离氧原子,有很强的杀毒消毒能力。常温常压下发生反应如下:反应①O3⇌O2+[O]△H>0 平衡常数为K1;
反应②[O]+O3=2O2△H<0 平衡常数为K2;
总反应:2O3=3O2△H<0 平衡常数为K
下列叙述正确的是( )
| A.升高温度,K增大 |
| B.K=K1+K2 |
| C.压强增大,K2减小 |
| D.适当升温,可提高消毒效率 |
对于反应aX(g)+bY(g) cZ(g)+dR(g) △H=QkJ/mol反应开始时,容器内充入X、Y或Z、R如图所示表示反应达到平衡后,图1、图2分别表示反应达到平衡后,改变温度和压强对反应的影响,下列叙述中正确的是
cZ(g)+dR(g) △H=QkJ/mol反应开始时,容器内充入X、Y或Z、R如图所示表示反应达到平衡后,图1、图2分别表示反应达到平衡后,改变温度和压强对反应的影响,下列叙述中正确的是

| A.开始时充入X和Y a+b>c+d Q<0 |
| B.开始时充入X和Y a+b>c+d Q>0 |
| C.开始时充入Z和R a+b>c+d Q<0 |
| D.开始时充入Z和R a+b<c+d Q>0 |
反应3Fe(s)+4H2O(g) Fe3O4(s)+4H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
Fe3O4(s)+4H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
| A.把Fe粉变成Fe片 |
| B.将容器的体积缩小一半 |
| C.保持容积不变,充入N2使容器压强增大 |
| D.压强不变,充入N2使容器体积增大 |
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如右图所示,下列描述正确的是:
| A.反应开始到10s,用Z表示的反应速率为0.158mol/(L•s) |
| B.反应开始到10s,X的物质的量浓度减少了0.79mol/L |
| C.反应开始到10s时,Y的转化率为79.0% |
D.反应的化学方程式为:X(g)+Y(g) Z(g) Z(g) |
一个恒容容器中盛有1molNO2,发生反应:2NO2(g) N2O4(g),反应达到平衡时,混合气体中NO2所占体积分数为M%。保持温度不变,再投入1molNO2,达到平衡时,混合气体中NO2所占体积分数为N%。则M和N的关系是
N2O4(g),反应达到平衡时,混合气体中NO2所占体积分数为M%。保持温度不变,再投入1molNO2,达到平衡时,混合气体中NO2所占体积分数为N%。则M和N的关系是
| A.M>N | B.M<N | C.M=N | D.不能确定 |
一定温度下,向aL体积固定的密闭容器中加入2molN2(g)、1moH2(g),发生如下反应:N2(g)+3H2(g) 3NH3(g),此反应达到平衡状态的标志是
3NH3(g),此反应达到平衡状态的标志是
| A.相同时间内消耗n mol N2的同时消耗3n mol H2 |
| B.H2的体积分数不再发生变化 |
| C.容器内原子总数不再发生变化 |
| D.容器内气体的密度不再发生变化 |
在不同温度下,向2L密闭容器中加入1molNO和1mol活性炭,发生反应: 2NO(g)+C(g) N2(g)+CO2(g)△H="-213.5kJ" mol-1,达到平衡时的数据如下:
N2(g)+CO2(g)△H="-213.5kJ" mol-1,达到平衡时的数据如下:
| 温度/℃ |
n(活性炭)/mol |
n(CO2)/mol |
| T1 |
0.70 |
|
| T2 |
|
0.25 |
下列说法不正确的是
A.上述信息可推知:T1<T2
B.T1℃时,该反应的平衡常数K=9/16
C.T1℃时,若开始时反应物的用量均减小一半,平衡后NO的转化率减
D.T2℃时,若反应达平衡后再缩小容器的体积,c(N2):c(NO)不变
下列说法正确的是
| A.含4molHCl的浓盐酸与足量MnO2充分反应,转移2NA个电子 |
B.500℃、30MPa下,将0.2mol N2和0.6molH2置于密闭的容器中反应生成NH3(g),反应达到平衡时放出的热量为7.72kJ,其热化学方程式为: △H=-38.6kJ·mol-1 △H=-38.6kJ·mol-1 |
C.对于可逆反应 △H﹤0,升高温度,可使反应速率增大,反应逆向移动 △H﹤0,升高温度,可使反应速率增大,反应逆向移动 |
| D.元素原子的最外层电子数的多少与其非金属性的强弱无必然联系。 |
已知一定温度下,X(g)+2Y(g) mZ(g);△H=-akJ/mol(a>0),现有甲、乙两容积相等且固定的密闭容器,在保持该温度下,向密闭容器甲中通入1molX和2molY,达到平衡状态时,放出热量bkJ;向密闭容器乙中通入2molX和4molY,达到平衡状态时,放出热量ckJ,且2b<c,则下列各值关系正确的是( )
mZ(g);△H=-akJ/mol(a>0),现有甲、乙两容积相等且固定的密闭容器,在保持该温度下,向密闭容器甲中通入1molX和2molY,达到平衡状态时,放出热量bkJ;向密闭容器乙中通入2molX和4molY,达到平衡状态时,放出热量ckJ,且2b<c,则下列各值关系正确的是( )
| A.a="b" | B.2a<c | C.m>3 | D.m<3 |
在一密闭容器中,反应aA(g)  bB(g),达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡后,B的浓度是原平衡的60%,则( )
bB(g),达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡后,B的浓度是原平衡的60%,则( )
| A.平衡向正反应方向移动了 | B.物质A的转化率减少了 |
| C.物质B的质量分数减小了 | D.a > b |
某温度下,体积一定的密闭容器中进行如下可逆反应:X(g)+Y(g) Z(g)+W(s)ΔH>0,下列叙述正确的是( )
Z(g)+W(s)ΔH>0,下列叙述正确的是( )
| A.加入少量W,逆反应速率增大 |
| B.升高温度,正反应速率增大,逆反应速率减小,平衡正向移动。 |
| C.当容器中气体压强不变时,反应达到平衡 |
| D.平衡后加入X,上述反应的ΔH增大 |
对可逆反应4NH3(g)+5O2(g)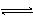 4NO(g)+6H2O(g),下列叙述正确的是()
4NO(g)+6H2O(g),下列叙述正确的是()
| A.化学反应速率关系是:2v正(NH3)=3v正(H2O) |
| B.若单位时间内生成xmolNO的同时,消耗xmolNH3,则反应达到平衡状态 |
| C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大 |
| D.达到化学平衡时,4v正(O2)=5v逆(NO) |
向绝热恒容密闭容器中通入SO2和NO2,在一定条件下使反应SO2(g)+NO2(g)⇌SO3(g)+NO(g)达到平衡,正反应速率随时间变化的如上图所示.由图可得出的正确结论是( )

| A.反应物的总能量低于生成物的总能量 |
| B.反应物浓度:a点小于b点 |
| C.△t1=△t2时,SO2的转化率:a~b段小于b~c段 |
| D.反应在c点达到平衡状态 |
试题篮
()