已知真空炼铷的原理如下:2RbCl+Mg = MgCl2+2Rb(g)。对于此反应的进行能给予正确解释的是( )
| A.铷的金属活动性不如镁强,镁可置换出铷 |
| B.铷的沸点比镁低,把铷蒸气抽出时,平衡向右移 |
| C.铷的单质状态较化合态更稳定 |
| D.MgCl2的热稳定性不如RbCl强 |
.当下列反应达到平衡时,保持温度不变,向容器中通Ar,化学平衡一定不移动的是( )
A.PCl5(g) 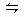 PCl3(g)+Cl2(g) PCl3(g)+Cl2(g) |
B.N2(g)+3H2(g)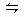 2NH3(g) 2NH3(g) |
C.2HI(g) 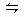 H2(g)+I2(g) H2(g)+I2(g) |
D.C2H4(g)+H2(g)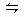 C2H6(g) C2H6(g) |
化学反应C(s)+H2O(g) 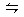 CO(g)+H2(g) ΔH>0达到平衡,下列叙述中正确的是 ( )
CO(g)+H2(g) ΔH>0达到平衡,下列叙述中正确的是 ( )
| A.升高温度,正反应速率增大,逆反应速率减小,平衡向正反应方向移动 |
| B.加入固体碳,平衡向正反应方向移动 |
| C.加入水蒸气使容器内压强增大,平衡向逆反应方向移动 |
| D.扩大容器容积,平衡向正反应方向移动 |
α1和α2分别为A在两个恒容容器中平衡体系A(g) 2B(g)和2A(g)
2B(g)和2A(g) B(g)的转化率,在温度不变的情况下,均增加A的物质的量,下列判断正确的是( )
B(g)的转化率,在温度不变的情况下,均增加A的物质的量,下列判断正确的是( )
| A.α1、α2均增大 | B.α1、α2均减小 |
| C.α1减小、α2增大 | D.α1增大、α2减小 |
一定温度下,在一定容的密闭容器中充入NO2发生如下反应:2NO2 N2O4并达到平衡,此时NO2的转化率为P%,再次充入NO2,其转化率将( )
N2O4并达到平衡,此时NO2的转化率为P%,再次充入NO2,其转化率将( )
| A.增大 | B.减小 | C.不变 | D.无法确定 |
已知真空炼铷的原理如下:2RbCl+Mg MgCl2+2Rb(g)。对于此反应的进行能给予正确解释的是( )。
MgCl2+2Rb(g)。对于此反应的进行能给予正确解释的是( )。
| A.铷的金属活动性不如镁强,镁可置换出铷 |
| B.铷的沸点比镁低,把铷蒸气抽出时,平衡向右移 |
| C.铷的单质状态较化合态更稳定 |
| D.MgCl2的热稳定性不如RbCl强 |
下列平衡体系中,升温或减压都使平衡向右移动的是 ( )
A.N2(g)+3H2(g)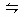 2NH3(g);ΔH<0 2NH3(g);ΔH<0 |
B.N2(g)+O2(g)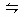 2NO(g);ΔH<0 2NO(g);ΔH<0 |
C.C(s)+H2O(g)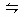 CO(g)+H2(g);ΔH>0 CO(g)+H2(g);ΔH>0 |
D.2SO2(g)+O2(g)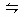 2SO3(g);ΔH<0 2SO3(g);ΔH<0 |
在已处于化学平衡状态的体系中,如果下列量发生变化,其中一定表明平衡发生移动的量是 ( )
| A.反应混合物的浓度 | B.反应物的转化率 |
| C.正、逆反应速率 | D.体系的压强 |
一定温度时于密封容器中发生反应:m A (g)+n B (g)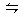 p C(g),达到平衡后,若将气体体积压缩到原来的一半,当再达平衡时C的溶液是原来的1.9倍,则下列叙述正确的是 ( )
p C(g),达到平衡后,若将气体体积压缩到原来的一半,当再达平衡时C的溶液是原来的1.9倍,则下列叙述正确的是 ( )
| A.平衡向正反应方向移动 | B.C气体的质量分数增大 |
| C.气体A的转化率降低 | D.m+n>p |
氙和氟单质按一定比例混合,在一定条件下反应达到如下平衡:Xe(g)+2F2(g)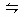 XeF4(g) △H<0,下列措施中既能加快反应速率,又能使平衡向正反应方向移动的是( )
XeF4(g) △H<0,下列措施中既能加快反应速率,又能使平衡向正反应方向移动的是( )
| A.升温 | B.加压 | C.减压 | D.降温 |
在一烧瓶中,在25℃时存在着平衡:2NO2 N2O4;ΔH<0。把烧瓶置于100℃的水中,则下列几项性质①颜色;②平均相对分子质量;③质量;④压强;⑤密度。不会改变的是 ( )
N2O4;ΔH<0。把烧瓶置于100℃的水中,则下列几项性质①颜色;②平均相对分子质量;③质量;④压强;⑤密度。不会改变的是 ( )
| A.①和③ | B.②和④ | C.④和⑤ | D.③和⑤ |
对于m A (g)+n B (g) p C(g)+q D(g)的平衡体系,当升高温度时,平衡混合气体对氢气的相对密度从16.5变成16.9,则下列说法正确的是 ( )
p C(g)+q D(g)的平衡体系,当升高温度时,平衡混合气体对氢气的相对密度从16.5变成16.9,则下列说法正确的是 ( )
| A.m+n> p+q,正反应是放热反应 |
| B.m+n> p+q,正反应是吸热反应 |
| C.m+n< p+q,逆反应是放热反应 |
| D.m+n< p+q,逆反应是吸热反应 |
试题篮
()