在一密闭容器中进行以下可逆反应:M(g)+N(g) P(g)+2L,在不同的条件下P的百分含量P%的变化情况如下图,则该反应
P(g)+2L,在不同的条件下P的百分含量P%的变化情况如下图,则该反应
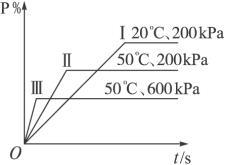
| A.正反应放热,L是固体 |
| B.正反应放热,L是气体 |
| C.正反应吸热,L是气体 |
| D.正反应放热,L是固体或气体 |
在容积为2升的密闭容器中,有反应:mA(g)+nB(g)  pC(g)+qD(g),经过5分钟达到平衡,此时,各物质的变化为:A减少了amol·L-1,B的平均反应速度VB=
pC(g)+qD(g),经过5分钟达到平衡,此时,各物质的变化为:A减少了amol·L-1,B的平均反应速度VB= mol·L-1·min-1,C增加了
mol·L-1·min-1,C增加了 mol·L-1,这时,若增加系统压强,发现A与C的百分含量不变,则m︰n︰p︰q为
mol·L-1,这时,若增加系统压强,发现A与C的百分含量不变,则m︰n︰p︰q为
| A.1︰1︰1︰1 | B.1︰3︰2︰2 |
| C.1︰3︰2︰1 | D.3︰1︰2︰2 |
一定温度下,l mol X和n mol Y在体积为2L的密闭容器中发生如下反应:X(g)+Y(g) 2Z(g)+M(s),5min后达到平衡,此时生成2a mol Z。下列说法正确的是
2Z(g)+M(s),5min后达到平衡,此时生成2a mol Z。下列说法正确的是
| A.用M表示此反应的反应速率γ(M)="0.1a" mol·(L·min)-1 |
| B.当混合气体的质量不再发生变化时,说明反应达到平衡状态 |
| C.向平衡后的体系中加入l mol M,平衡向逆反应方向移动 |
| D.向上述平衡体系中再充入l mol X,平衡正向移动,因为此时γ正增大,γ逆减小 |
在体积为VL的密闭容器中存在化学平衡:2NO2(g) N2O4(g)ΔH<0。保持温度不变,将容器体积压缩至V/2后,下列说法不正确的是
N2O4(g)ΔH<0。保持温度不变,将容器体积压缩至V/2后,下列说法不正确的是
| A.容器内气体颜色变深 |
| B.容器内NO2分子数减少 |
| C.混合气体的平均相对分子质量增大 |
| D.NO2的物质的量分数增大 |
某温度下在容积为2 L的密闭容器中,发生2X(g)+Y(g) 2W(g)的反应,当充入1 mol X和1 mol Y,经20 s达到平衡时生成了0.4 mol W。下列说法正确的是
2W(g)的反应,当充入1 mol X和1 mol Y,经20 s达到平衡时生成了0.4 mol W。下列说法正确的是
| A.若升高温度,W的体积分数减小,则该反应ΔH<0 |
| B.以Y的浓度变化表示的反应速率为0.01 mol/(L·s) |
| C.在其他条件不变的情况下,增加1 mol X,则X和Y的转化率均提高 |
| D.增大压强正反应速率增大,逆反应速率减小,则平衡向正反应方向移动 |
如图所示曲线表示其他条件一定时,反应:2NO+O2 2NO2 ΔH<0,NO的转化率与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)>v(逆)的点是
2NO2 ΔH<0,NO的转化率与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)>v(逆)的点是
| A.a点 | B.b点 |
| C.c点 | D.d点 |
在某温度下,将2 mol A和3 mol B充入一密闭容器中,发生反应:aA(g)+B(g) C(g)+D(g),5 min后达平衡,已知各物质的平衡浓度的关系为ca(A)·c(B)=c(C)·c(D)。若在温度不变的情况下,将容器的体积扩大为原来的10倍,A 的转化率没有发生变化,则B的转化率为
C(g)+D(g),5 min后达平衡,已知各物质的平衡浓度的关系为ca(A)·c(B)=c(C)·c(D)。若在温度不变的情况下,将容器的体积扩大为原来的10倍,A 的转化率没有发生变化,则B的转化率为
A.60% B.40% C.24% D.4%
如图是可逆反应N2(g)+3H2(g) 2NH3(g) 在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是
2NH3(g) 在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是
| A.t1时,只有正方向反应 |
| B.t2时,反应到达限度 |
| C.t2-t3,反应不再发生 |
| D.t2-t3,各物质的浓度相等且不再发生变化 |
一定温度下,可逆反应2NO2(g)  2NO(g)+O2(g)在体积固定的密闭容器中反应,达到平衡状态的标志是
2NO(g)+O2(g)在体积固定的密闭容器中反应,达到平衡状态的标志是
①单位时间内生成n mol O2,同时生成2n mol NO2
②单位时间内生成n mol O2,同时生成2n mol NO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2∶2∶1
④混合气体的压强不再改变
⑤混合气体的颜色不再改变
⑥混合气体的平均相对分子质量不再改变
| A.①④⑤⑥ | B.①②③⑤ | C.②③④⑥ | D.以上全部 |
在一定体积的密闭容器中给定物质A、B、C的量,在一定条件下发生反应建立的化学平衡:aA(g)+bB(g) xC(g),符合下图所示的关系(C%表示平衡混合气中产物C的百分含量,T表示温度,P表示压强)。在图中Y轴是指
xC(g),符合下图所示的关系(C%表示平衡混合气中产物C的百分含量,T表示温度,P表示压强)。在图中Y轴是指

①反应物A的转化率,②平衡混合气中物质B的百分含量,
③平衡混合气的密度,④平衡混合气的平均摩尔质量
A.①③ B.②③ C.③④ D.①④
在恒容密闭容器中进行N2+3H2 2NH3反应,起始时N2和H2分别为10 mol 和30 mol,当达到平衡时,N2的转化率为30%。若以NH3作为起始反应物,反应条件与上述反应相同时,要使其反应达到平衡时各组成成分的物质的量分数与前者相同,则NH3的起始物质的量和它的转化率正确的是
2NH3反应,起始时N2和H2分别为10 mol 和30 mol,当达到平衡时,N2的转化率为30%。若以NH3作为起始反应物,反应条件与上述反应相同时,要使其反应达到平衡时各组成成分的物质的量分数与前者相同,则NH3的起始物质的量和它的转化率正确的是
| A.40 mol 35% | B.20 mol 30% |
| C.20 mol 70% | D.10 mol 50% |
在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应X(g)+Y(g)  2Z(g) △H < 0, 一段时间后达到平衡,反应过程中测定的数据如下表:
2Z(g) △H < 0, 一段时间后达到平衡,反应过程中测定的数据如下表:
| t/min |
2 |
4 |
7 |
9 |
| n(Y)/mol |
0.12 |
0.11 |
0.10 |
0.10 |
下列说法正确的是
A.反应前2min的平均速率ν(Z)=2.0×10-3mol·L-1·min-1
B.其他条件不变,降低温度,反应达到新平衡前ν(逆)> ν(正)
C.该温度下此反应的平衡常数K=1.44
D.其他条件不变,再充入0.2molZ,平衡时X的体积分数增大
反应2Z(g)===X(g)+ Y(g) ,△H>0.达到平衡时,下列说法正确的是
| A.加入催化剂,X的产率增大 |
| B.升高温度,Y的转化率增大 |
| C.当容器活塞可活动时,充入稀有气体,平衡不移动 |
| D.充入Z气体时,Z的转化率增大 |
对可逆反应N2(g)+3H2(g) 2NH3(g),△H=-92.4 kJ.mol-1下列叙述正确的是
2NH3(g),△H=-92.4 kJ.mol-1下列叙述正确的是
| A.达到化学平衡时,若升高温度,则正反应速率减小,逆反应速率增大 |
| B.若单位时间内消耗x mol N2,同时生成2x mol NH3,则反应达到平衡状态 |
| C.若达到平衡时,共放出46.2kJ热量,则有l mo1NH3(g)生成 |
| D.达到平衡后,将容器体积减小为原来的一半,重新达到平衡后,c(NH3)变为原平衡时的2倍 |
试题篮
()