在一定温度下的定容密闭容器中,当下列物理量不再变化时,不能表明反应:
A(s)+2B(g) C(g)+D(g)已达到化学平衡状态的是
C(g)+D(g)已达到化学平衡状态的是
| A.C的物质的量浓度 | B.混合气体的密度 |
| C.容器内压强 | D.混合气体的平均分子量 |
一定温度下,可逆反应3X(g)+Y(g)  2Z(g)达到限度的标志是
2Z(g)达到限度的标志是
| A.单位时间内生成3n mol X,同时消耗n mol Y |
| B.X的生成速率与Z的生成速率相等 |
| C.X、Y、Z的浓度相等 |
| D.X、Y、Z的分子个数比为3:1:2 |
在一定条件下,合成氨反应达到化学平衡后,混合气体中NH3的体积占25%,若维持反应条件不变,则反应后缩小的体积和原反应物体积的比值为
| A.1︰5 | B.1︰4 | C.1︰3 | D.1︰2 |
已知298 K时,合成氨反应N2(g)+3H2(g) 2NH3(g)ΔH=-92.0 kJ·mol-1,将此温度下的1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应。测得反应放出的热量为(假定测量过程中没有能量损失)
2NH3(g)ΔH=-92.0 kJ·mol-1,将此温度下的1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应。测得反应放出的热量为(假定测量过程中没有能量损失)
| A.一定小于92.0 kJ | B.一定大于92.0 kJ |
| C.一定等于92.0 kJ | D.无法确定 |
在容积可变的密闭容器中,2molN2和8molH2在一定条件下发生反应,达到平衡时,H2的转化率为25%,则平衡时氮气的转化率近于
| A.20% | B.25% | C.33% | D.35% |
一定条件下在一容积恒为2L的容器内发生反应:2A(g) + B(g)  2C(g) ,已知起始投入4mol A(g) 和2mol B(g),经2s后测得C的浓度为0.6 mol/ L,并且2s后各组分浓度不再改变。下列说法正确的是
2C(g) ,已知起始投入4mol A(g) 和2mol B(g),经2s后测得C的浓度为0.6 mol/ L,并且2s后各组分浓度不再改变。下列说法正确的是
| A.2s内用物质A表示的平均反应速率为0.3 mol/(L·s) |
| B.2s内用物质B表示的平均反应速率为0.6 mol/(L·s) |
| C.2s后每有0.6mol的物质B生成,同时就有0.6mol物质C生成 |
| D.2s时物质B的浓度为0.7mol/L |
已知2SO2(g)+O2(g)====2SO3(g)(正反应放热)。若在500℃和催化剂的作用下,该反应在容积固定的密闭容器中进行,下列有关说法正确的是
| A.降低温度,可以加快反应速率 |
| B.使用催化剂是为了加快反应速率 |
| C.在上诉条件下,SO2能完全转化成SO3 |
| D.到达平衡时,SO2和SO3的浓度一定相等 |
相同温度和压强下,在容积为2 L的密闭容器中发生反应:2HI(g) H2(g)+I2(g),达到平衡状态的标志是
H2(g)+I2(g),达到平衡状态的标志是
| A.c(H2)保持不变 |
| B.c(H2)= c(I2) |
C.2 (HI)= (HI)= (I2) (I2) |
| D.拆开2 mol H-I共价键,同时生成1 mol H-H共价键 |
下图所示的直型石英玻璃封管中充有CO气体,左端放置不纯的镍(Ni)粉。在一定条件下,Ni可以与CO(g)发生如下反应:

但Ni粉中的杂质不与CO(g)发生反应。玻璃管内左右两端的温度分别稳定在350K和470K,经过足够长时间后,右端的主要物质是
| A.纯Ni(s)和Ni(CO)4(g) | B.纯Ni(s)和CO(g) |
| C.不纯Ni(s)和CO(g) | D.不纯Ni(s)和Ni(CO)4(g) |
可逆反应a A(s)+bB(g)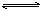 c C(g)+dD(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如下图下列叙述正确的是
c C(g)+dD(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如下图下列叙述正确的是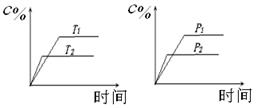
| A.达平衡后,加入催化剂则C%增大 |
| B.达平衡后,若升温,平衡左移 |
| C.化学方程式中b >c +d |
| D.达平衡后,增加A的量有利于平衡向右移动 |
在一定温度下的定容密闭容器中,当下列物理量不再变化时,能表明反应:A(s)+2B(g)  C(g)+D(g) 已达平衡的是
C(g)+D(g) 已达平衡的是
A.混合气体的压强 B.混合气体的密度
C.A的颜色 D.2V(B)正=V(C)逆
合成氨所需的氢气可用煤和水作原料经过多步反应制得,其中的一步反应为:CO(g)+H2O(g) CO2(g)+H2(g) △H< 0 反应到达平衡后,为提高CO的转化率,下列措施中正确的是
CO2(g)+H2(g) △H< 0 反应到达平衡后,为提高CO的转化率,下列措施中正确的是
| A.降低温度 | B.增加压强 | C.增大CO的浓度 | D.更换催化剂 |
碘钨灯比白炽灯使用寿命长。灯管内封存的少量碘与使用过程中沉积在管壁上的钨可以发生反应:WI2(g) W(s)+I2(g) ΔH>0。下列说法正确的是
W(s)+I2(g) ΔH>0。下列说法正确的是
| A.灯管工作时,扩散到灯丝附近高温区的WI2(g)会分解出W重新沉积到灯丝上 |
| B.灯丝附近温度越高,WI2(g)的转化率越低 |
C.该反应的平衡常数表达式是 |
| D.灯内温度升高时,压强不会变 |
试题篮
()