在一定温度下的定容密闭容器中,当物质的下列物理量不再发生变化时,表明反应A(g)+2B(g) C(g)+D(g)已达到平衡状态的是
C(g)+D(g)已达到平衡状态的是
| A.混合气体的密度 | B.混合气体的总物质的量 |
| C.混合气体的压强 | D.混合气体的总体积 |
将一定量纯净的氨基甲酸铵固体置于密闭容器中,发生反应:NH2COONH4(s)  2NH3(g)+CO2(g)。该反应的平衡常数的负对数(-lgK)值随温度(T)的变化曲线如图所示,下列说法不正确的是
2NH3(g)+CO2(g)。该反应的平衡常数的负对数(-lgK)值随温度(T)的变化曲线如图所示,下列说法不正确的是

A.该反应的△H>0
B.NH3的体积分数不变时,该反应一定达到平衡状态
C.A点对应状态的平衡常数K(A)=10-2.294
D.30℃时,B点对应状态的υ(正))<υ(逆)
下列事实,不能用勒夏特列原理解释的是
A.溴水中有平衡:Br2+ H2O  HBr+ HBrO 加入 AgNO3溶液后,溶液颜色变浅 HBr+ HBrO 加入 AgNO3溶液后,溶液颜色变浅 |
B.对CO(g) + NO2 (g)  CO2(g)+ NO(g) 平衡体系增大压强可使颜色变深 CO2(g)+ NO(g) 平衡体系增大压强可使颜色变深 |
| C.升高温度能够增大硝酸钾在水中的溶解度 |
| D.合成 NH3反应,为提高 NH3的产率,理论上应采取相对较低温度的措施 |
已知:25℃时, Ksp(FeS)=6.3×10-18;Ksp(CuS)=1.3×10-36;Ksp(ZnS)=1.6×10-24.下列叙述正确的是
| A.25℃时,FeS、ZnS、CuS的溶解度依次增大 |
| B.ZnS饱和溶液这加入少量Na2S固体,平衡后溶液中c(Zn2+)·c(S2-)=Ksp,c(Zn2+)=c(S2-) |
| C.除去工业废水中的Cu2+,可用FeS作为沉淀剂 |
| D.某溶液中含有Fe2+、Cu2+和Zn2+,浓度均为0.010mol/L。向该溶液中逐滴加入0.010mol/L的Na2S溶液时,Fe2+最先沉淀出来 |
X、Y、Z三种气体,取X和Y按1∶1的物质的量之比混合,放入密闭容器中发生如下反应:
X+2Y 2Z,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3∶2,则Y的转化率最接近于
2Z,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3∶2,则Y的转化率最接近于
| A.66% | B.60% | C.50% | D.33% |
下列事实不能用勒沙特列原理解释的有( )
①铁在潮湿的空气中容易生锈;
②实验室可用排饱和食盐水的方法收集氯气;
③常温下,将1mL pH=3的醋酸溶液加水稀释至100mL,测得其pH<5;
④钠与氯化钾共融制备钾Na(l)+KCl(l) K(g)+NaCl(l);
K(g)+NaCl(l);
⑤二氧化氮与四氧化二氮的平衡体系,加压后颜色加深.
| A.2个 | B.3个 | C.4个 | D.5个 |
在一定体积的密闭容器中给定物质A、B、C的量,在一定条件下发生反应建立的化学平衡:aA(g)+bB(g) xC(g),符合下图所示的关系(C%表示平衡混合气中产物C的百分含量,T表示温度,P表示压强)。在图中Y轴是指
xC(g),符合下图所示的关系(C%表示平衡混合气中产物C的百分含量,T表示温度,P表示压强)。在图中Y轴是指

①反应物A的转化率,②平衡混合气中物质B的百分含量,
③平衡混合气的密度,④平衡混合气的平均摩尔质量
A.①③ B.①④ C.②③ D.③④
在一密闭容器中进行如下反应:3H2(气)+N2(气) 2NH3(气),已知反应过程中某一时 刻 H2、N2、NH3的浓度分别为 0.3mol/L、0.1mol/L、0.2mol/L,当反应达平衡时,可能存在的数据是( )
2NH3(气),已知反应过程中某一时 刻 H2、N2、NH3的浓度分别为 0.3mol/L、0.1mol/L、0.2mol/L,当反应达平衡时,可能存在的数据是( )
| A.H2为 0.6mol/L、N2为 0. 2mol/L | B.NH3为 0.25mol/L |
| C.N2、NH3均为 0.15mol/L | D.NH3为 0.4mol/L |
可逆反应2SO2 (g)+ O2 (g)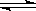 2SO3(g)达到平衡的标志是
2SO3(g)达到平衡的标志是
① 消耗2 mol SO2的同时生成2 mol SO3
②SO2、O2与SO3的物质的量之比为2∶1∶2
③ 反应混合物中,SO3的质量分数不再改变
| A.①② | B.①③ | C.只有③ | D.只有① |
对于反应2CO(g)+ O2(g) 2CO2(g)(ΔH<0),在一定条件下建立化学平衡后,下列各条件变化时,能使平衡向正方向移动的是
2CO2(g)(ΔH<0),在一定条件下建立化学平衡后,下列各条件变化时,能使平衡向正方向移动的是
| A.恒容通入少量He | B.恒容通入少量CO2 |
| C.升高温度 | D.缩小容器体积 |
下列各物质的颜色变化不是由平衡移动引起的是( )
| A.H2、I2、HI平衡混合气体加压颜色变深 |
| B.氯水光照颜色变浅 |
| C.NO2、N2O4混合气体加热颜色变深 |
| D.FeCl3和KSCN的混合溶液中加入FeCl3固体,溶液颜色加深 |
对已经达到化学平衡状态的下列反应2X(g)+Y2(g) Z(g),减小压强时,对反应产生的影响是( )
Z(g),减小压强时,对反应产生的影响是( )
| A.v正、v逆都减小,平衡逆向移动 | B.v正、v逆都增大,平衡正向移动 |
| C.v逆增大,v正减小,平衡逆向移动 | D.v逆减小,v正增大,平衡正向移动 |
下列生产、生活等实际应用,不能用勒夏特列原理解释的是( )
| A.实验室配制FeCl3溶液时,应向其中加入少量浓盐酸 |
| B.合成氨工业中使用铁触媒做催化剂 |
| C.饱和FeCl3溶液滴入沸水中可制得氢氧化铁胶体 |
| D.热的纯碱溶液去油污效果好 |
一定温度下,将NO2与SO2以体积比为1:2置于密闭容器中发生NO2(g)+SO2(g) SO3(g)+NO(g) △H=" -41.8" kJ•mol-1,测得上述反应平衡时NO2与SO2体积比为1:6,下列说法正确的是( )
SO3(g)+NO(g) △H=" -41.8" kJ•mol-1,测得上述反应平衡时NO2与SO2体积比为1:6,下列说法正确的是( )
| A.平衡常数K=8/3 |
| B.达到平衡后NO2和SO2的转化率相等 |
| C.SO3和NO的体积比保持不变可以证明达到平衡状态 |
| D.每消耗1molSO3的同时生成1molNO2 |
试题篮
()