图像能直观地反映有关物理量的变化及规律,下列各图像与描述相符的是




图1 图2 图3 图4
| A.图1表示SO2氧化反应分别在有、无催化剂的情况下反应过程中的能量变化 |
| B.图2表示0.1 mol MgCl2·6H2O在空气中充分加热时固体质量随时间的变化 |
| C.图3表示分别稀释1 mL pH=2的盐酸和醋酸时溶液pH的变化,图中b>100mL |
D.图4表示平衡2NO2(g) N2O4(g)在t1时迅速将体积缩小后c(N2O4)的变化 N2O4(g)在t1时迅速将体积缩小后c(N2O4)的变化 |
COCl2(g) CO(g)+ Cl2(g) ΔH>0 当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO的浓度 ④扩大容积 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是
CO(g)+ Cl2(g) ΔH>0 当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO的浓度 ④扩大容积 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是
| A.①②④ | B.①④⑥ | C.②③⑥ | D.③⑤⑥ |
某化学反应中,反应混合物A、B、C的物质的量浓度(c)与时间(t)关系如下表所示:
| |
初始 |
2 min |
4 min |
6 min |
| c (A)(mol/L) |
1.45 |
1.28 |
1.00 |
1.00 |
| c (B)(mol/L) |
0.38 |
0.72 |
1.28 |
1.28 |
| c (C)(mol/L) |
0.095 |
0.18 |
0.32 |
0.32 |
下列说法正确的是( )
A.该反应的化学方程式为A = 2B+C
B.4 min末A的转化率约为31%
C.4~6min时,反应停止了
D.正反应是吸热反应
在某2L恒容密闭容器中充入2 mol X(g)和1 mol Y(g)发生反应:2X(g)+Y(g) 3Z(g)△H,反应过程中持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。下列推断正确的是
3Z(g)△H,反应过程中持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。下列推断正确的是
| A.M点时,Y的转化率最大 |
| B.升高温度,平衡常数减小 |
| C.平衡后充入Z达到新平衡时Z的体积分数增大 |
| D.W,M两点Y的正反应速率相等 |
某化学小组研究在其他条件不变时,改变密闭容器中某一条件对A2(g)+ 3B2(g) 2AB3(g)化学平衡状态的影响,得到如下图所示的曲线(图中T表示温度,n表示物质的量)下列判断正确的是
2AB3(g)化学平衡状态的影响,得到如下图所示的曲线(图中T表示温度,n表示物质的量)下列判断正确的是
A.若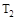 > >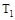 ,则正反应是放热反应 ,则正反应是放热反应 |
B.达到平衡时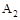 的转化率大小为:b>a>c 的转化率大小为:b>a>c |
C.若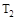 > >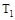 ,达到平衡时b、d点的反应速率为 ,达到平衡时b、d点的反应速率为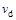 > >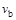 |
D.在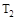 和 和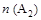 不变时达到平衡, 不变时达到平衡,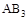 的物质的量大小为:c>b>a 的物质的量大小为:c>b>a |
向甲乙两个容积均为1L的恒容容器中,分别充入2molA、2molB和1molA、1molB。相同条件下,发生下列反应:A(g)+B(g) xC(g);△H<0。测得两容器中c(A)随时间t的变化如图所示。下列说法正确的是
xC(g);△H<0。测得两容器中c(A)随时间t的变化如图所示。下列说法正确的是
A.x可能等于2也可能等于3
B.向平衡后的乙容器中充入氦气可使c(A)增大
C.将乙容器单独升温可使乙容器内各物质的体积分数与甲容器内的相同
D.若向甲容器中再充入2molA、2molB,则平衡时甲容器中0.78mol·L-1<c(A)<1.56mol·L-1
下列事实不能用勒夏特列原理来解释的是( )
| A.高压有利于氢气与氮气合成氨 |
| B.实验室中常用排饱和食盐水的方法收集Cl2 |
| C.用V2O5催化二氧化硫氧化为三氧化硫 |
| D.Cl2在水中的溶解度大于在饱和NaCl溶液中的溶解度 |
在一密闭容器中进行如下反应:3H2(气)+N2(气) 2NH3(气),已知反应过程中某一时 刻 H2、N2、NH3的浓度分别为 0.3mol/L、0.1mol/L、0.2mol/L,当反应达平衡时,可能存在的数据是( )
2NH3(气),已知反应过程中某一时 刻 H2、N2、NH3的浓度分别为 0.3mol/L、0.1mol/L、0.2mol/L,当反应达平衡时,可能存在的数据是( )
| A.H2为 0.6mol/L、N2为 0. 2mol/L | B.NH3为 0.25mol/L |
| C.N2、NH3均为 0.15mol/L | D.NH3为 0.4mol/L |
可逆反应2SO2 (g)+ O2 (g)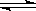 2SO3(g)达到平衡的标志是
2SO3(g)达到平衡的标志是
① 消耗2 mol SO2的同时生成2 mol SO3
②SO2、O2与SO3的物质的量之比为2∶1∶2
③ 反应混合物中,SO3的质量分数不再改变
| A.①② | B.①③ | C.只有③ | D.只有① |
对于反应2CO(g)+ O2(g) 2CO2(g)(ΔH<0),在一定条件下建立化学平衡后,下列各条件变化时,能使平衡向正方向移动的是
2CO2(g)(ΔH<0),在一定条件下建立化学平衡后,下列各条件变化时,能使平衡向正方向移动的是
| A.恒容通入少量He | B.恒容通入少量CO2 |
| C.升高温度 | D.缩小容器体积 |
下列各物质的颜色变化不是由平衡移动引起的是( )
| A.H2、I2、HI平衡混合气体加压颜色变深 |
| B.氯水光照颜色变浅 |
| C.NO2、N2O4混合气体加热颜色变深 |
| D.FeCl3和KSCN的混合溶液中加入FeCl3固体,溶液颜色加深 |
对已经达到化学平衡状态的下列反应2X(g)+Y2(g) Z(g),减小压强时,对反应产生的影响是( )
Z(g),减小压强时,对反应产生的影响是( )
| A.v正、v逆都减小,平衡逆向移动 | B.v正、v逆都增大,平衡正向移动 |
| C.v逆增大,v正减小,平衡逆向移动 | D.v逆减小,v正增大,平衡正向移动 |
下列生产、生活等实际应用,不能用勒夏特列原理解释的是( )
| A.实验室配制FeCl3溶液时,应向其中加入少量浓盐酸 |
| B.合成氨工业中使用铁触媒做催化剂 |
| C.饱和FeCl3溶液滴入沸水中可制得氢氧化铁胶体 |
| D.热的纯碱溶液去油污效果好 |
一定温度下,将NO2与SO2以体积比为1:2置于密闭容器中发生NO2(g)+SO2(g) SO3(g)+NO(g) △H=" -41.8" kJ•mol-1,测得上述反应平衡时NO2与SO2体积比为1:6,下列说法正确的是( )
SO3(g)+NO(g) △H=" -41.8" kJ•mol-1,测得上述反应平衡时NO2与SO2体积比为1:6,下列说法正确的是( )
| A.平衡常数K=8/3 |
| B.达到平衡后NO2和SO2的转化率相等 |
| C.SO3和NO的体积比保持不变可以证明达到平衡状态 |
| D.每消耗1molSO3的同时生成1molNO2 |
试题篮
()