已知2SO2(g)+ O2(g) 2SO3(g);△H=-197kJ/mol,同温下,往相同体积的密闭容器甲、乙中分别充入2molSO2、1molO2 和1molSO3、1molSO2、0.5mol O2,当它们分别达到平衡时放出的热量为Q1 KJ和Q2KJ,则下列比较正确的是( )
2SO3(g);△H=-197kJ/mol,同温下,往相同体积的密闭容器甲、乙中分别充入2molSO2、1molO2 和1molSO3、1molSO2、0.5mol O2,当它们分别达到平衡时放出的热量为Q1 KJ和Q2KJ,则下列比较正确的是( )
| A.Q2=" 1/2" Q1="98.5" | B.Q2="1/2" Q1<98.5 | C.Q2<1/2 Q1<98.5 | D.1/2 Q1< Q2 <98.5 |
在一密闭容器中,用等物质的量的A和B发生如下反应:A(g)+2B(g)  2C(g),反应达到平衡时,若混合气体A和B的物质的量之和与C的物质的量相等,则这时A的转化率为 ( )
2C(g),反应达到平衡时,若混合气体A和B的物质的量之和与C的物质的量相等,则这时A的转化率为 ( )
| A.40% | B.50% | C.60% | D.70% |
某温度下的密闭容器中,反应2A(g) B(g) △H<0,达到平衡后,c(A)/c(B)= a,若改变某一条件,反应再次平衡,此时c(A)/c(B)=b,下列叙述正确的是
B(g) △H<0,达到平衡后,c(A)/c(B)= a,若改变某一条件,反应再次平衡,此时c(A)/c(B)=b,下列叙述正确的是
A.在该温度下,保持容积固定不变,向容器内补充B气体,则a>b
B.保持温度、压强不变,充入惰性气体,则有a=b
C.若其他条件不变,升高温度,则有a>b
D.若a=b,容器中一定使用了催化剂
在一密闭容器中进行如下反应:3H2(气)+N2(气) 2NH3(气),已知反应过程中某一时 刻 H2、N2、NH3的浓度分别为 0.3mol/L、0.1mol/L、0.2mol/L,当反应达平衡时,可能存在的数据是( )
2NH3(气),已知反应过程中某一时 刻 H2、N2、NH3的浓度分别为 0.3mol/L、0.1mol/L、0.2mol/L,当反应达平衡时,可能存在的数据是( )
| A.H2为 0.6mol/L、N2为 0. 2mol/L | B.NH3为 0.25mol/L |
| C.N2、NH3均为 0.15mol/L | D.NH3为 0.4mol/L |
可逆反应2SO2 (g)+ O2 (g)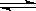 2SO3(g)达到平衡的标志是
2SO3(g)达到平衡的标志是
① 消耗2 mol SO2的同时生成2 mol SO3
②SO2、O2与SO3的物质的量之比为2∶1∶2
③ 反应混合物中,SO3的质量分数不再改变
| A.①② | B.①③ | C.只有③ | D.只有① |
对于反应2CO(g)+ O2(g) 2CO2(g)(ΔH<0),在一定条件下建立化学平衡后,下列各条件变化时,能使平衡向正方向移动的是
2CO2(g)(ΔH<0),在一定条件下建立化学平衡后,下列各条件变化时,能使平衡向正方向移动的是
| A.恒容通入少量He | B.恒容通入少量CO2 |
| C.升高温度 | D.缩小容器体积 |
下列各物质的颜色变化不是由平衡移动引起的是( )
| A.H2、I2、HI平衡混合气体加压颜色变深 |
| B.氯水光照颜色变浅 |
| C.NO2、N2O4混合气体加热颜色变深 |
| D.FeCl3和KSCN的混合溶液中加入FeCl3固体,溶液颜色加深 |
对已经达到化学平衡状态的下列反应2X(g)+Y2(g) Z(g),减小压强时,对反应产生的影响是( )
Z(g),减小压强时,对反应产生的影响是( )
| A.v正、v逆都减小,平衡逆向移动 | B.v正、v逆都增大,平衡正向移动 |
| C.v逆增大,v正减小,平衡逆向移动 | D.v逆减小,v正增大,平衡正向移动 |
下列生产、生活等实际应用,不能用勒夏特列原理解释的是( )
| A.实验室配制FeCl3溶液时,应向其中加入少量浓盐酸 |
| B.合成氨工业中使用铁触媒做催化剂 |
| C.饱和FeCl3溶液滴入沸水中可制得氢氧化铁胶体 |
| D.热的纯碱溶液去油污效果好 |
一定温度下,将NO2与SO2以体积比为1:2置于密闭容器中发生NO2(g)+SO2(g) SO3(g)+NO(g) △H=" -41.8" kJ•mol-1,测得上述反应平衡时NO2与SO2体积比为1:6,下列说法正确的是( )
SO3(g)+NO(g) △H=" -41.8" kJ•mol-1,测得上述反应平衡时NO2与SO2体积比为1:6,下列说法正确的是( )
| A.平衡常数K=8/3 |
| B.达到平衡后NO2和SO2的转化率相等 |
| C.SO3和NO的体积比保持不变可以证明达到平衡状态 |
| D.每消耗1molSO3的同时生成1molNO2 |
在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
| 物质 |
X |
Y |
Z |
| 初始浓度/mol·L-1 |
0.1 |
0.2 |
0 |
| 平衡浓度/mol·L-1 |
0.05 |
0.05 |
0.1 |
下列说法错误的是
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X+3Y 2Z,其平衡常数为1600
2Z,其平衡常数为1600
C.增大压强可使平衡向生成Z的方向移动,平衡常数增大
D.改变温度可以改变此反应的平衡常数
将固体NH4I置于密闭容器中,在某温度下发生下列反应:NH4I(s)  NH3(g)+HI(g),2HI(g)
NH3(g)+HI(g),2HI(g)  H2(g)+I2(g)。当反应达到平衡时,c(H2)=0.5mol·L-1,c(HI)=4mol·L-1,则NH3的浓度为
H2(g)+I2(g)。当反应达到平衡时,c(H2)=0.5mol·L-1,c(HI)=4mol·L-1,则NH3的浓度为
| A.3.5mol·L-1 | B.4mol·L-1 | C.4.5mol·L-1 | D.5mol·L-1 |
2008年1月8日,国家主席胡锦涛在人民大会堂为获得2007年国家最高科学技术奖的石油化工催化剂专家闵恩泽教授颁奖,以表彰他在催化剂研究方面做出的突出贡献。下列关于催化剂的说法正确的是
| A.使用催化剂可以增大正反应速率,减小逆反应速率 |
| B.使用催化剂可以使化学平衡正向移动 |
| C.使用催化剂可以降低反应的活化能 |
| D.使用催化剂可以改变反应的平衡常数 |
已知298 K时,合成氨反应N2(g)+3H2(g)  2NH3(g) ΔH=-92.0 kJ·mol-1,将此温度下的1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量为(假定测量过程中没有能量损失):
2NH3(g) ΔH=-92.0 kJ·mol-1,将此温度下的1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量为(假定测量过程中没有能量损失):
| A.一定大于92.0 kJ | B.无法确定 |
| C.一定小于92.0 kJ/mol | D.一定小于92.0 kJ |
试题篮
()