已知:A(g)+B(g) C(g)+D(g)
C(g)+D(g)  kJ/mol,相同温度下,在体积均为2L的三个恒温密闭容器中,加入一定量的反应物发生反应。相关数据如下:
kJ/mol,相同温度下,在体积均为2L的三个恒温密闭容器中,加入一定量的反应物发生反应。相关数据如下:
下列说法中,不正确的是
A.若容器①中反应10min达到平衡,0~10min时间内,用A表示的平均反应速率v(A)=4.0×10-2mol/(L·min)
B.平衡时,①与②容器中A的体积分数相等
C.③达平衡时体系能量的变化主要为热能转化为化学能
D.容器③中,开始时v(B)生成>v(B)消耗
在恒温恒容条件下,向容积为2L的密闭容器中充入2.0molSO2和2.0molO2。已知:2SO2(g)+O2(g) 2SO3(g) ∆H=-akJ/mol(a>0),经2min达到平衡状态,反应放热0.25akJ。下列判断正确的是
2SO3(g) ∆H=-akJ/mol(a>0),经2min达到平衡状态,反应放热0.25akJ。下列判断正确的是
| A.在1min时:c(SO3)+c(SO2)="1.0" mol·L-1 |
| B.在2min内:v(SO2)="0.25" mol·L-1·min-1 |
| C.若再充入2molSO3,达到平衡时SO3的质量分数减小 |
| D.反应条件相同,若起始时向反应容器充入2molSO3,达到平衡时反应吸热0.75 akJ |
一定温度下,某一密闭恒容的容器内存在可逆反应A(g)+3B(s) 2C(g),可判断其达到化学平衡状态的是
2C(g),可判断其达到化学平衡状态的是
A.当生成C的速率为0时
B.容器内混合气体的密度不随时间而变化
C.单位时间内生成n molA,同时生成3n molB
D.A、B、C的分子数之比为1:3:2
在体积一定的密闭容器中给定物质A、B、C的量,在一定条件下发生反应建立的化学平衡:aA(g) + bB(g) xC(g),符合下图所示的关系(c%表示平衡混合气中产物C的百分含量,T表示温度,p表示压强)。在图中,Y轴是指
xC(g),符合下图所示的关系(c%表示平衡混合气中产物C的百分含量,T表示温度,p表示压强)。在图中,Y轴是指
A.反应物A的百分含量 B.平衡混合气中物质B的百分含量
C.平衡混合气的密度 D.平衡混合气的平均摩尔质量
已知:2CH3OH(g) CH3OCH3(g)+H2O(g);ΔH=-25 kJ·mol-1,某温度下的平衡常数为400。此温度下,在1 L的密闭容器中加入CH3OH,反应到某时刻测得各组分的物质的量浓度如下表,下列说法正确的是
CH3OCH3(g)+H2O(g);ΔH=-25 kJ·mol-1,某温度下的平衡常数为400。此温度下,在1 L的密闭容器中加入CH3OH,反应到某时刻测得各组分的物质的量浓度如下表,下列说法正确的是
| 物质 |
CH3OH |
CH3OCH3 |
H2O |
| c/(mol·L-1) |
0.8 |
1.24 |
1.24 |
A. 平衡后升高温度,平衡常数>400
B. 平衡时,c(CH3OCH3)=1.6 mol·L-1
C. 平衡时,反应混合物的总能量减少40 kJ
D. 平衡时,再加入与起始等量的CH3OH,达新平衡后CH3OH转化率增大
一定条件下存在反应:2SO2(g) +O2(g) 2SO3(g),ΔH<0。现有三个体积相同的密闭容器Ⅰ、Ⅱ、Ⅲ,按如下图所示投料,并在400℃条件下开始反应。达到平衡时,下列说法正确的是
2SO3(g),ΔH<0。现有三个体积相同的密闭容器Ⅰ、Ⅱ、Ⅲ,按如下图所示投料,并在400℃条件下开始反应。达到平衡时,下列说法正确的是
| A.容器I、Ⅲ中平衡常数相同 |
| B.容器II、Ⅲ中正反应速率相同 |
| C.容器Ⅱ、Ⅲ中的反应达平衡时,SO3的体积分数:II>III |
| D.容器I中SO2的转化率与容器Ⅱ中SO3的转化率之和小于1 |
下列图示与对应的叙述相符的是
| A.图甲表示向CH3COOH溶液中逐步加入CH3COONa固体后,溶液pH的变化 |
| B.图乙表示向CH3COOH溶液中加水时溶液的导电性变化,则CH3COOH溶液的pH:a>b |
| C.图丙表示催化剂能改变化学反应的焓变 |
| D.图丁表示等量NO2在容积相同的恒容密闭容器中,不同温度下分别发生反应: |
2NO2(g) N2O4(g),相同时间后测得NO2含量的曲线,则该反应的△H<0
N2O4(g),相同时间后测得NO2含量的曲线,则该反应的△H<0
在一定温度下,X 与 Y 发生反应:X(aq)+m Y(aq)  n Z(aq),下图为反应在不同条件下达到平衡时,X、Y、Z 三种物质的平衡浓度。甲为1L溶液中 X与Y按起始物质的量比 5:7 混合,使反应达到平衡。乙和丙是将甲溶液按不同比例稀释后,使反应重新达到平衡。下列判断正确的是
n Z(aq),下图为反应在不同条件下达到平衡时,X、Y、Z 三种物质的平衡浓度。甲为1L溶液中 X与Y按起始物质的量比 5:7 混合,使反应达到平衡。乙和丙是将甲溶液按不同比例稀释后,使反应重新达到平衡。下列判断正确的是
| A.m :n =" 3" :2 | B.K = 8 |
C.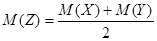 |
D.起始物质的量n(X)=1mol |
下列图示与对应的叙述相符的是
| A.由图1所示曲线可知,化学催化比酶催化的效果好 |
| B.在H2S溶液导电性实验中,由图2所示曲线可确定通入的气体X为Cl2 |
C.在其它条件不变时,2SO2(g)+ O2(g) 2SO3(g)转化关系(图3)中,纵坐标表示O2的转化率 2SO3(g)转化关系(图3)中,纵坐标表示O2的转化率 |
| D.图4是用0.l000 mol·L-1的盐酸滴定20.00 mL 0.l000mol·L-1 Na2CO3溶液的曲线,从a→b点反应的离子方程式为:HCO3-+H+= CO2↑+H2O |
将0.20 mol NO和0.1 mol CO充入一个容积恒定为1L的密闭容中发生反应:2NO(g)+2CO(g) N2(g)+2CO2(g) △H<0在不同条件下,反应过程中部分物质的浓度变化如图所示。
N2(g)+2CO2(g) △H<0在不同条件下,反应过程中部分物质的浓度变化如图所示。
下列说法正确的是
| A.容器内的压强不发生变化说明该反应达到平衡 |
| B.当向容器中再充入0.20 mol NO时,平衡向正反应方向移动,K增大 |
| C.第12 min时改变的反应条件为升高温度 |
| D.向该容器内充入He气,容器内气体压强增大,所以反应速率增大 |
同温度下,体积均为1L的两个恒容密闭容器中发生可逆反应:N2(g)+3H2(g) 2NH3(g) △H=-92.6kJ/mol.测得数据如表
2NH3(g) △H=-92.6kJ/mol.测得数据如表
| 容器编号 |
起始时各物质物质的量/mol |
达到平衡时体系能量的变化 |
||
| N2 |
H2 |
NH3 |
||
| (1) |
2 |
3 |
0 |
27.78kJ |
| (2) |
1.6 |
1.8 |
0.8 |
Q |
下列叙述不正确的是( )
A.容器(1)(2)反应达平衡时压强相等
B.容器(2)中反应开始时v(正)>v(逆)
C.容器(2)中反应达平衡时,吸收的热量Q为9.26kJ
D.若条件为“绝热恒容”,容器(1)中反应达平衡时n(NH3)<0.6mol
臭氧的脱硝反应为:2NO2(g)+O3(g) N2O5(g)+O2(g),一定条件下,向2.0 L恒容密闭容器中充入2.0 mol NO2和1.0 mol O3,一段时间后达到平衡。下图曲线a表示该反应在温度T下O3的浓度随时间的变化,曲线b表示该反应在某一起始条件改变时O3的浓度随时间的变化。下列叙述正确的是
N2O5(g)+O2(g),一定条件下,向2.0 L恒容密闭容器中充入2.0 mol NO2和1.0 mol O3,一段时间后达到平衡。下图曲线a表示该反应在温度T下O3的浓度随时间的变化,曲线b表示该反应在某一起始条件改变时O3的浓度随时间的变化。下列叙述正确的是
A.反应2NO2(g)+O3(g) N2O5(g)+O2(g) △S<0 N2O5(g)+O2(g) △S<0 |
| B.曲线b对应的条件改变可能是加入了催化剂,平衡常数Ka=Kb |
| C.曲线b对应的条件改变可能是密闭容器的体积变为4.0 L |
| D.若c1=0.3mol·L-1,从反应开始到平衡时该反应的速率v(NO2)=0.005 mol·L-1·s-1 |
700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g) CO2(g)+H2(g)。反应过程中测定的部分数据见下表(表中
CO2(g)+H2(g)。反应过程中测定的部分数据见下表(表中 <
< )。下列说法正确的是
)。下列说法正确的是
A.反应在 min内的平均速率为 min内的平均速率为 |
| B.温度升至800℃,上述反应平衡常数为0.64,则正反应为吸热反应 |
C.保持其他条件不变,若向平衡体系中再通入0.20mol ,与原平衡相比,达到新平衡时CO和 ,与原平衡相比,达到新平衡时CO和 的转化率均增大 的转化率均增大 |
D.保持其他条件不变,若起始时向容器中充入0.60molCO和1.20 mol ,则到达平衡时, ,则到达平衡时, ="0.40" mol ="0.40" mol |
试题篮
()