一定条件下,对于可逆反应N2(g)+3H2(g) 2NH3(g),若X、Y、Z的起始浓度分别为C1、C2、C3(均不为零),到达平衡时,N2、H2、NH3的浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.08 mol·L-1,则下列判断正确的是
2NH3(g),若X、Y、Z的起始浓度分别为C1、C2、C3(均不为零),到达平衡时,N2、H2、NH3的浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.08 mol·L-1,则下列判断正确的是
| A.C1:C2=1:3 |
| B.平衡时,H2和NH3的生成速率之比为2:3 |
| C.N2、H2的转化率之比为1:3 |
| D.C1的取值范围为0.04 mol·L-1<C1<0.14 mol·L-1 |
一定温度下,有可逆反应:2A(g)+2B(g) C(g)+3D(g) ΔH<0。现将2molA和2molB充入体积为V的甲容器,将2molC和6molD充入乙容器并使乙容器在反应开始前的体积为2V(如图1)。
C(g)+3D(g) ΔH<0。现将2molA和2molB充入体积为V的甲容器,将2molC和6molD充入乙容器并使乙容器在反应开始前的体积为2V(如图1)。
关于两容器中反应的说法正确的是
| A.甲容器中的反应先达到化学平衡状态 |
| B.两容器达平衡后升高相同的温度,两容器中物质D的体积分数随温度变化如图2所示 |
| C.两容器中的反应均达平衡时,平衡混合物中各组份的体积百分组成相同,混合气体的平均相对分子质量也相同 |
| D.在甲容器中再充入2molA和2molB,平衡后甲中物质C的浓度与乙中物质C的浓度相等 |
向某密闭容器中加入0.3mol A、0.1mol C和一定量的B三种气体,一定条件下发生反应,各物质浓度随时间变化如图1所示.图2为t2时刻后改变容器中条件,平衡体系中速率随时间变化的情况,且四个阶段都各改变一种条件,所用条件均不同.已知t3~t4阶段为使用催化剂.下列说法错误的是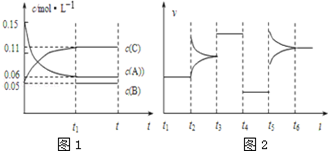
A. 若t1=15s,生成物C在 t0~t1时间段的平均反应速率为0.004 mol•L﹣1•s﹣1
B. t4~t5阶段改变的条件为减小压强,t5~t6阶段改变的条件是升高化学反应的温度
C. B的起始物质的量为0.02 mol
D. 该化学反应的表达式为:3A(g)⇌B(g)+2C(g)
一定条件下存在反应:(
)+
2
(
)

2(
)+
2(
),其正反应放热。现有三个相同的2L恒容绝热(与外界没有热量交换) 密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1
和1
2
,在Ⅱ中充入1
2和1
2,在Ⅲ中充入2
和2
2
,700℃条件下开始反应。达到平衡时,下列说法正确的是( )
| A. | 容器Ⅰ、Ⅱ中正反应速率相同 |
| B. | 容器Ⅰ、Ⅲ中反应的平衡常数相同 |
| C. |
容器Ⅰ中
|
| D. |
容器Ⅰ中
|
氮氧化物是大气污染物之一,消除氮氧化物的方法有多种。

(1)利用甲烷催化还原氮氧化物。已知:
①CH4 (g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H =-574 kJ/mol
②CH4(g)+4NO(g) = 2N2(g)+CO2(g)+2H2O(g) △H =-1160 kJ/mol
则CH4 将NO2 还原为N2 的热化学方程式为: 。
(2)利用NH3催化还原氮氧化物(SCR技术)。该技术是目前应用最广泛的烟气氮氧化物脱除技术。 反应的化学方程式为:2NH3(g)+NO(g)+NO2(g)  2N2(g)+3H2O(g) △H<0
2N2(g)+3H2O(g) △H<0
为提高氮氧化物的转化率可采取的措施是 (写出1条即可)。
(3)利用ClO2氧化氮氧化物。其转化流程如下:NO NO2
NO2 N2。已知反应Ⅰ的化学方程式为2NO+ ClO2 + H2O =NO2 + HNO3 + HCl,则反应Ⅱ的化学方程式是 ;若生成11.2 L N2(标准状况),则消耗ClO2 g 。
N2。已知反应Ⅰ的化学方程式为2NO+ ClO2 + H2O =NO2 + HNO3 + HCl,则反应Ⅱ的化学方程式是 ;若生成11.2 L N2(标准状况),则消耗ClO2 g 。
(4)用活性炭还原法处理氮氧化物.有关反应为:C(s)+2NO(g) N2 (g)+CO2 (g)△H.某研究小组向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2 (g)+CO2 (g)△H.某研究小组向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
| 浓度/mol•L-1/ 时间/min |
NO |
N2 |
CO2 |
| 0 |
0.100 |
0 |
0 |
| 10 |
0.058 |
0.021 |
0.021 |
| 20 |
0.040 |
0.030 |
0.030 |
| 30 |
0.040 |
0.030 |
0.030 |
| 40 |
0.032 |
0.034 |
0.017 |
| 50 |
0.032 |
0.034 |
0.017 |
①T1℃时,该反应的平衡常数K= 0.56(保留两位小数).
②30min后,改变某一条件,反应重新达到平衡,则改变的条件可能是 .
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,
则该反应的△H <0(填“>”、“=”或“<”).
在恒温恒容的密闭容器中,发生反应3A(g)+B(g) xC(g)。
xC(g)。
Ⅰ、将3molA和2molB在一定条件下反应,达平衡时C的体积分数为a;
Ⅱ、若起始时A、B、C投入的物质的量分别为n(A)、n(B)、n(C),平衡时C的体积分数也为a。
下列说法正确的是
A、若Ⅰ达平衡时,A、B、C各增加1mol,则B的转化率将一定增大
B、若向Ⅰ平衡体系中再加入3molA和2molB,C的体积分数若大于a,可断定x>4
C、若x=2,则Ⅱ体系起始物质的量应当满足3 n(B) =n(A)+3
D、若Ⅱ体系起始物质的量当满足3 n(C) +8n(A)="=12" n(B)时,可断定x=4
工业上常用还原沉淀法处理含铬废水(Cr2O72—和CrO42—),其流程为:
已知:
(1)步骤①中存在平衡:2CrO42—(黄色)+2H+ Cr2O72—(橙色)+H2O
Cr2O72—(橙色)+H2O
(2)步骤③生成的Cr(OH)3在溶液中存在沉淀溶解平衡:Cr(OH)3(s) Cr3+(aq)+3OH 一(aq)
Cr3+(aq)+3OH 一(aq)
(3)常温下,Cr(OH)3的溶度积Ksp=10-32;且当溶液中离子浓度小于10-5 mol·L-1时可视作该离子不存在.下列有关说法中,正确的是
| A.步骤①中加酸,将溶液的pH 调节至2,溶液显黄色,CrO42—离子浓度增大 |
| B.步骤①中当溶液呈现深黄色,且2v(CrO42 一)=v(Cr2O72—)时,说明反应 2CrO42—(黄色)+2H+  Cr2O72—(橙色)+H2O 达到平衡状态 Cr2O72—(橙色)+H2O 达到平衡状态 |
| C.步骤②中,若要还原1 mol Cr2O72一离子,需要6 mol(NH4)2Fe(SO4)2·6H2O。 |
| D.步骤③中,当将溶液的pH 调节至4 时,可认为废水中的铬元素已基本除尽 |
在容积固定不变的密闭容器中,可逆反应:A2(g)+B2(g) nC(g)符合下列图1所示关系。由此推断,对图Ⅱ的说法不正确的是( )
nC(g)符合下列图1所示关系。由此推断,对图Ⅱ的说法不正确的是( )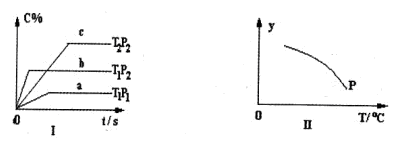
| A.Y轴表示A2的转化率 | B.Y轴表示C的浓度 |
| C.Y轴表示混合气体的密度 | D.Y轴表示混合气体的平均摩尔质量 |
下列图示与对应的叙述不相符的是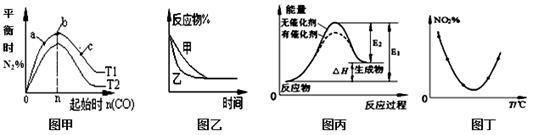
A.图甲表示反应:4CO(g)+2NO2(g) N2(g)+4CO2(g) ΔH <0,在其他条件不变的情况下,改变起始物CO的物质的量对此反应平衡的影响,则有T1>T2,K1>K2 N2(g)+4CO2(g) ΔH <0,在其他条件不变的情况下,改变起始物CO的物质的量对此反应平衡的影响,则有T1>T2,K1>K2 |
B.图乙表示压强对可逆反应2A(g)+2B(g) 3C(g)+D(g)的影响,乙的压强比甲的压强大 3C(g)+D(g)的影响,乙的压强比甲的压强大 |
| C.图丙表示的反应是吸热反应,该图表明催化剂不能改变化学反应的焓变 |
D.图丁表示等量NO2在容积相同的恒容密闭容器中,不同温度下分别发生反应:2NO2(g) N2O4(g),相同时间后测得NO2含量的曲线,则该反应的△H<0 N2O4(g),相同时间后测得NO2含量的曲线,则该反应的△H<0 |
T℃时,将1molX和2molY投入2L的密闭容器中,发生反应:X(g)+Y(g)  2Z(g),X、Y的量随时间变化如下表,该反应的平衡常数随温度的变化如下图,则下列判断正确的是( )
2Z(g),X、Y的量随时间变化如下表,该反应的平衡常数随温度的变化如下图,则下列判断正确的是( )

| |
0 |
1 |
2 |
3 |
4 |
5 |
6 |
| X |
1 |
0.80 |
0.66 |
0.58 |
0.52 |
0.50 |
0.50 |
| Y |
2 |
1.80 |
1.66 |
… |
… |
… |
… |
A.前5min用Z表示的平均反应速率为0.2mol/(L·min)
B.该反应的正反应是放热反应,且T1>T
C.在T℃时,以1molX、2molY和1molZ充入上述容器中,达到平衡时,X的体积分数不变
D.若温度为T1时,以同样的起始量反应,达到平衡时X的转化率为66.7%
在一密闭容器中有如下反应:aX(g)+bY(g) nW(g);ΔH ,某化学兴趣小组的同学根据此反应在不同条件下的实验数据,作出了如下曲线图:
nW(g);ΔH ,某化学兴趣小组的同学根据此反应在不同条件下的实验数据,作出了如下曲线图:
其中,ω(W)表示W在反应混合物中的体积分数,t表示反应时间。当其它条件不变时,下列分析正确的是
| A.图Ⅰ可能是不同压强对反应的影响,且p2>p1,a+b>n |
| B.图Ⅱ可能是不同压强对反应的影响,且p1>p2,n<a+b |
| C.图Ⅱ可能是在同温同压下催化剂对反应的影响,且1使用的催化剂效果好 |
| D.图Ⅲ可能是不同温度对反应的影响,且T1>T2,ΔH<0 |
一定温度下,容积为2 L的甲、乙两固定容积的密闭容器中,发生反应: 2SO2(g)+O2(g) 2SO3(g)。达平衡时测得有关数据如下表:
2SO3(g)。达平衡时测得有关数据如下表:
| 容 器 |
甲 |
乙 |
| 反应物投入量 |
2 mol SO2、1 mol O2 |
4 mol SO3 |
| n(SO3)/mol |
1.6 |
a |
| 反应物的转化率 |
α1 |
α2 |
下列说法正确的是( )
A.α1+α2>1
B.1.6<a<3.2
C.若甲中反应2 min时达到平衡,则2 min 内平均速率ν(O2)=" 0.2" mol·L-1·min-1
D.甲平衡后再加入0.2 mol SO2、0.2 mol O2和0.4 mol SO3,平衡逆向移动
在容积不变的密闭容器中存在如下反应:2SO2(g)+O2(g)  2SO3(g) ΔH<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是
2SO3(g) ΔH<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是
| A.图Ⅰ表示的是t1时刻增大O2的浓度对反应速率的影响 |
| B.图Ⅱ表示的是t1时刻加入催化剂后对反应速率的影响 |
| C.图Ⅲ表示的是催化剂对平衡的影响,且甲的催化效率比乙高 |
| D.图Ⅲ表示的是压强对化学平衡的影响,且乙的压强较高 |
一定条件下,在体积为10L的固定容器中发生的反应:N2+3H2 2NH3,反应过程如下图所示,下列说法正确的是
2NH3,反应过程如下图所示,下列说法正确的是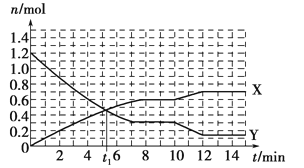
| A.t1 min时正、逆反应速率相等 |
| B.X曲线表示NH3的物质的量随时间变化的关系 |
| C.0~8 min,H2的平均反应速率v(H2)=0.75 mol·L-1·min-1 |
| D.10~12 min,N2的平均反应速率为v(N2)=0.25mol·L-1·min-1 |
向某密闭容器中加入0.3 mol A、0.1 mol C和一定量的B三种气体。一定条件下发生反应,各物质的浓度随时间变化如甲图所示[t0~t1阶段的c(B)变化未画出]。乙图为t2时刻后改变条件平衡体系中正、逆反应速率随时间变化的情况,且四个阶段都各改变一种反应条件且互不相同,t3时刻为使用催化剂。下列说法中正确的是
A.若t1=15 s,用A的浓度变化表示t0~t1阶段的平均反应速率为0.004 mol·L-1·s-1
B.t4~t5阶段改变的条件一定为减小压强
C.该容器的容积为2 L,B的起始物质的量为0.02 mol
D.t5~t6阶段,若容器内A的物质的量减少了0.06 mol,而此过程中容器与外界的热交换总量为a kJ,该反应的热化学方程式3A(g) B(g)+2C(g)ΔH=-50a kJ·mol-1
B(g)+2C(g)ΔH=-50a kJ·mol-1
试题篮
()