已知298K时,2SO2(g)+O2(g)==2SO3;△H=-197kj/mol。
在相同温度和压强下,向密闭容器中通入2molSO2和1molO2,达到平衡时放出热量Q1,向另一个体积相同的容器中通入1molSO2、0.5molO2和1molSO3,达到平衡时放出热量Q2。则下列关系式正确的是……( )
| A.Q2=Q1=197kJ | B.Q1<Q2<197kJ | C.Q2<Q1<197kJ | D.Q1=Q2<197kJ |
可逆反应mA(g)+nB==pC(g)+qD中,A和D都是无色气体,达到平衡后,下列叙述正确的是(双选)……( )
A、若增加B的量,平衡体系颜色加深,说明B必是气体
B、增大压强,平衡不移动,说明m+n一定等于p+q
C、升高温度,A的转化率减小,说明正反应是吸热反应
D、若B是气体,增大A的量,A、B的转化率并不都增大
完全相同的两个容器A和B,已知:A中SO2和O2各1g;B中装有SO2和O2各2g;在同温度下反应达到平衡时,A中SO2的转化率为a%,B中SO2的转化率为b%。则A、B两容器SO2的转化率关系正确的是……( )
A、a%>b% B、a%=b% C、a%<b% D、无法确定
将1molCO与1molH2O(气)混合,在一定条件下反应:CO+H2O==CO2(气)+H2(气),达到平衡时,CO的转化率为21.75%。则平衡混合气体的平均密度是相同条件下H2密度的( )倍。
| A.5.75 | B.11.5 | C.23 | D.46 |
在500℃时,发生可逆反应2SO2(g)+O2(g)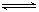 2SO3(g);ΔH<0。向甲容器中充入1molSO2和0.5molO2,向相同容积的乙容器中充入1molSO3。若甲容器保持容积不变,乙容器保持压强不变,分别达平衡,下列说法不正确的是:
2SO3(g);ΔH<0。向甲容器中充入1molSO2和0.5molO2,向相同容积的乙容器中充入1molSO3。若甲容器保持容积不变,乙容器保持压强不变,分别达平衡,下列说法不正确的是:
| A.平衡时,容器内的压强:甲>乙 | B.反应达平衡时所需时间:甲<乙 |
| C.平衡时,氧气的浓度:甲<乙 | D.平衡时,容器内SO3的体积百分数:甲>乙 |
压强对合成氨反应具有重要的影响。下表是反应达到平衡时压强与NH3含量的一些实验数据:
| 压强/MPa |
10 |
20 |
30 |
60 |
100 |
| NH3含量(体积分数)/% |
81.5 |
86.4 |
89.9 |
95.4 |
98.8 |
从表中数据可以推断:随着压强增大,平衡时NH3含量
| A.增加 | B.减少 | C.先增加,后减少 | D.先减少,后增加 |
在一定温度下,将等物质的量的CO和水蒸气通人恒容密闭容器中,发生如下反应:
CO(g)+H2O(g)  CO2(g)+H2(g),一段时间后反应达到平衡。对该平衡状态描述正确的是
CO2(g)+H2(g),一段时间后反应达到平衡。对该平衡状态描述正确的是
| A.正反应速率等于零 | B.正反应速率大于逆反应速率 |
| C.正反应速率等于逆反应速率 | D.正反应速率小于逆反应速率 |
某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应A(g)+xB(g)  2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的如下图所示。下列说法中正确是
2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的如下图所示。下列说法中正确是
| A.30min时降低温度,40min时升高温度 |
| B.8min前A的平均反应速率为0.08mol/(L·min) |
| C.反应方程式中的x=1,正反应为吸热反应 |
| D.20min~40min间该反应的平衡常数均为4 |
在一定温度条件下,甲、乙两个容积相等的恒容密闭容器中均发生如下反应:3A(g)+B(g) xC(g)+D(s),向甲中通入6molA和2molB,向乙中通入1.5molA、0.5molB和3molC和2molD,反应一段时间后都达到平衡,此时测得甲、乙两容器中C的体积分数都为0.2,下列叙述中正确的是
xC(g)+D(s),向甲中通入6molA和2molB,向乙中通入1.5molA、0.5molB和3molC和2molD,反应一段时间后都达到平衡,此时测得甲、乙两容器中C的体积分数都为0.2,下列叙述中正确的是
A.若平衡时,甲、乙两容器中A的物质的量不相等,则x=4
B.平衡时,甲、乙两容器中A、B的物质的量之比不相等
C.平衡时甲中A的体积分数为40%
D.若平衡时两容器中的压强不相等,则两容器中压强之比为8∶5
在1 L的密闭容器中,充入1 mo1CO和1 mo1 H2O (g),于850℃时进行化学反应:CO(g) + H2O (g) CO2(g) + H2(g) △H<0,达平衡时,有50%的CO转化为CO2。在相同温度下,将1 mo1CO和4 mo1 H2O (g)充入同样的容器中,记录0~8分钟内测得容器内各物质的物质的量如下表。t分钟时为改变条件后达平衡时所测得的数据。下列说法正确的是
CO2(g) + H2(g) △H<0,达平衡时,有50%的CO转化为CO2。在相同温度下,将1 mo1CO和4 mo1 H2O (g)充入同样的容器中,记录0~8分钟内测得容器内各物质的物质的量如下表。t分钟时为改变条件后达平衡时所测得的数据。下列说法正确的是
| 时间/min |
n(CO)/ mo1 |
n(H2O)/mo1 |
n(CO2)/ mo1 |
n(H2)/ mo1 |
| 0 |
1 |
4 |
0 |
0 |
| 4 |
0.25 |
3.25 |
0.75 |
0.75 |
| 6 |
n1 |
n2 |
n3 |
n4 |
| 8 |
n1 |
n2 |
n3 |
n4 |
| t |
0.15 |
3.15 |
0.85 |
0.85 |
| A.前4 min,用CO表示的化学反应速率为v(CO)=0.25mol/(L·min) |
| B.反应在第4 min时处于化学平衡状态 |
| C.8分钟时,混合气体中CO2的体积分数为16% |
| D.t分钟时,反应所处的温度高于850℃ |
T℃时,将气体X与气体Y置于一密闭容器中,反应生成气体Z,反应过程中各物质的浓度变 化如图(I)所示。保持其他条件不变,在T1、T2两种温度下,Y的体积分数变化如图(Ⅱ)所示。下列结论正确的是

| A.t2时,保持其它条件和物质状态不变,增加压强,化学平衡向逆反应方向移动 |
| B.T℃时,若密闭容器中各物质起始浓度为:0.4 mol/L X、0.4 mol/L Y、0.2 mol/L Z。保持其他条件不变,达到平衡时z的浓度为0.4 mol/L |
| C.图(Ⅱ)中T1>T2,则正反应是吸热反应 |
| D.其他条件不变,升高温度,正、逆反应速率均增大,且X的转化率增大 |
如右图所示,当关闭阀门K时,向甲中充入2molSO2和1molO2,在800℃时发生反应:
 .1min时反应达平衡状态,有3/4的SO2转化为SO3. 在800℃时,向乙中充入2molSO3.起始时,甲、乙的体积均为1L。下列说法正确的是( )
.1min时反应达平衡状态,有3/4的SO2转化为SO3. 在800℃时,向乙中充入2molSO3.起始时,甲、乙的体积均为1L。下列说法正确的是( )
A.在800℃,若向甲的平衡体系中,再充入lmolS03气,达到薪平衡时,SO3的体积分数增大
B.800℃时,乙中反应达到平衡状态时,其气体体积小于1.125L
C若打开阀门K,新的平衡混合气中SO3的体积分数比打开K前甲、乙中的都大
D.800℃时,乙中反应 的平衡常数为24
的平衡常数为24
现代炼锌的方法可分为火法和湿法两大类。火法炼锌是将闪锌矿(主要含ZnS)通过浮选、
焙烧使它转化为氧化锌,再把氧化锌和足量焦炭混合,在鼓风炉中加热至1373~1573K,使锌蒸馏出来。主要反应为:
焙烧炉中:2ZnS+3O2=2ZnO+2SO2 ①
鼓风炉中:2C+O2=2CO ②
ZnO (s)+CO (g)  Zn (g)+CO2 (g) ③
Zn (g)+CO2 (g) ③
假设鼓风炉体积固定且密闭,随反应的进行鼓风炉内不同时间气态物质的物质的量浓度(mol/L)如下表
| 反应进行时间/min |
CO |
Zn |
CO2 |
| 0 |
0.11 |
0 |
0 |
| 2 |
0.1 |
0.01 |
0.01 |
| 30 |
c1 |
c2 |
c2 |
| 35 |
c1 |
c2 |
c2 |
(1) 若保持温度不变,在鼓风炉中增大CO的浓度,K值 (填“增大”、“减小”或“不变”);
(2) 已知:该温度时,化学平衡常数K=1.0,则表中c1= (写出计算过程)
(3) 假设通过改变反应条件,若使焙烧炉中反应①的ZnO几乎完全被CO还原,焙烧炉和鼓风炉消耗的O2的体积比不超过 。
(4) 若起始浓度不变,通过改变反应条件,达平衡时鼓风炉中反应③CO的转化率为80%,此时该反应的平衡常数K= ,此时焙烧炉和鼓风炉消耗的O2的体积比大于
已知NO2和N2O4可以相互转化:2NO2(g) N2O4(g) △H<0。在恒温条件下将一定量NO2和N2O4的混合气体通入一容积为2 L的密闭容器中,反应物浓度随时间变化
N2O4(g) △H<0。在恒温条件下将一定量NO2和N2O4的混合气体通入一容积为2 L的密闭容器中,反应物浓度随时间变化
关系如右图。下列说法正确的是
| A.图中的两条曲线,X是表示NO2浓度随时间的变化曲线 |
| B.前10 min内用v(NO2)表示的化学反应速率为0.06 mol/(L·min) |
| C.25 min时,导致平衡移动的原因是将密闭容器的体积缩小为1L |
| D.a、b、c、d四个点中,只有b、d点的化学反应处于平衡状态 |
试题篮
()