.对可逆反应来说,使用催化剂的作用是( )
| A.提高反应物的平衡转化率 |
| B.以同样程度改变正逆反应的速度 |
| C.增大正反应速度,减小逆反应速度 |
| D.改变平衡混合物的组成 |
在高温下,反应2HBr(g) H2(g)+Br2(g);△H>0,达化学平衡时,要使混合气体的颜色加深,可采取的方法是( )
H2(g)+Br2(g);△H>0,达化学平衡时,要使混合气体的颜色加深,可采取的方法是( )
| A.减小压强 | B.缩小体积 |
| C.升高温度 | D.增大氢气的物质的量浓度 |
合成氨工业上采用循环操作,主要是因为( )
| A.加快反应速率 | B.能提高NH3的平衡浓度 |
| C.降低NH3的沸点 | D.提高N2、H2的利用率 |
在可变容积的密闭容器中通入体积比为2∶3的气体A和气体B,在一定条件下发生如下反应:A(g)+3B(g)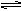 2C(g),当反应达化学平均时,测得有50%的B转化为C,则反应前与平衡时容器内的分子数之比是( )
2C(g),当反应达化学平均时,测得有50%的B转化为C,则反应前与平衡时容器内的分子数之比是( )
| A.5∶6 | B.5∶4 | C.5∶3 | D.5∶2 |
.对于达到平衡状态的可逆反应:N2+3H2 2NH3 △H<0,下列说法正确的是( )
2NH3 △H<0,下列说法正确的是( )
| A.反应物和生成物的浓度 |
| B.反应物和生成物的浓度不再发生变化 |
| C.降低温度,平衡混合物中NH3的浓度减少 |
| D.增大压强,不利于氨的合成 |
乙酸蒸气能形成二聚分子:2CH3COOH(g) (CH3COOH)2(g);△H<0。现欲测定乙酸的分子量,应采用的条件为( )。
(CH3COOH)2(g);△H<0。现欲测定乙酸的分子量,应采用的条件为( )。
| A.高温、低压 | B.低温、高压 | C.低温、低压 | D.高温、高压 |
已知在等温、等容条件下,有如下可逆反应:2A(g)+2B(g) 3C(g)+D(g)。现分别从两条途径建立平衡,途径Ⅰ:A、B的起始浓度均为2mol/L;途径Ⅱ:C、D的起始浓度均为6mol/L和2mol/L。下列叙述正确的是( )
3C(g)+D(g)。现分别从两条途径建立平衡,途径Ⅰ:A、B的起始浓度均为2mol/L;途径Ⅱ:C、D的起始浓度均为6mol/L和2mol/L。下列叙述正确的是( )
A.Ⅰ、Ⅱ两途径最终达到平衡时,体系内混合气体的浓度相同
B.Ⅰ、Ⅱ两途径最终达到平衡时,体系内混合气体的百分组成相同
C.达到平衡时,Ⅰ途径的反应速率υ1等于Ⅱ途径的反应速率υ2
D.达到平衡时,Ⅰ途径混合气体的密度等于Ⅱ途径混合气体的密度
某温度下,向aL密闭容器中加入2mol NO2气体,发生如下反应:2NO2(g) 2NO(g)+O2(g),此时反应达到平衡状态的标志是( )
2NO(g)+O2(g),此时反应达到平衡状态的标志是( )
| A.混合气体的密度不再变化 |
| B.混合气体的颜色变浅 |
| C.混合气体中NO2、NO、O2的物质的量之比为2∶2∶1 |
| D.单位时间内生成2n mol NO,同时生成2n mol NO2 |
对达到平衡状态的可逆反应A+B C+D,在t1时增大压强,正、逆反应速率变化图象如图所示,下列有关A、B、C、D的状态叙述正确的是( )
C+D,在t1时增大压强,正、逆反应速率变化图象如图所示,下列有关A、B、C、D的状态叙述正确的是( )
A.A、B、C为气体,D不是气体
B.A、B为气体,C、D有一种为气体
C.C、D为气体,A、B有一种为气体
D.C、D为气体,A、B都不是气体
合成氨工业有下列流程:①原料气制备;②氨的合成;③原料气净化和压缩;④氨的分离。其先后顺序为( )
| A.①②③④ | B.①③②④ | C.④③②① | D.②③④① |
下列事实不能用勒夏特列原理解释的是( )
| A.煅烧粉碎的硫铁矿利于SO2的生成 |
B.对2HI(g) I2(g)+H2(g),增大压强可使平衡体系颜色变深 I2(g)+H2(g),增大压强可使平衡体系颜色变深 |
C.反应NO2+CO CO2+NO;ΔH<0,升高温度可使平衡向逆反应方向移动 CO2+NO;ΔH<0,升高温度可使平衡向逆反应方向移动 |
D.合成NH3反应:N2+3H2 2NH3ΔH<0,为提高NH3的产率,理论上应采取降低温度的措施 2NH3ΔH<0,为提高NH3的产率,理论上应采取降低温度的措施 |
有一处平衡状态的反应2X(s)+Y(g) 2Z(g)△H<0。为了使平衡向生成Z的方向移动,应采取的措施是( )
2Z(g)△H<0。为了使平衡向生成Z的方向移动,应采取的措施是( )
①升高温度;②降低温度;③增大压强;④减小压强;⑤加入催化剂;⑥及时分离出Z。
| A.①③⑤ | B.②③⑤ | C.②③⑥ | D.②④⑥ |
合成氨需要的H2由煤和水反应制得,其中一步反应为:CO(g)+H2O(g) CO2(g)+H2(g) △H>0,要使CO转化率提高,可采取( )
CO2(g)+H2(g) △H>0,要使CO转化率提高,可采取( )
| A.增大H2O(g)的浓度 | B.增大CO的浓度 |
| C.降低温度 | D.增大压强 |
试题篮
()