已知 2 mol SO2 (g) 氧化为2 mol SO3 (g) 的能量变化如图所示: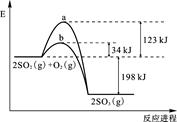
(1)写出SO2 (g) 氧化为SO3 (g) 的热化学方程式:
(2)氧化SO2时,工业上常加入V2O5作催化剂,其反应机理可表示为
SO2 + V2O5 = SO3 + 2VO2, 4VO2 + O2 = 2V2O5;
上图中表示加入V2O5的反应曲线为 (填“a”或“b”)。
(3)若在容积为2 L的密闭容器中充入2 mol SO2 (g)和1 mol O2 (g),如图甲所示,经2 min达到平衡,测得放出热量为178.2 kJ,则:
①2 min内 O2的化学反应速率v(O2)= ;
②若再充入1 mol O2重新达到平衡时,SO3平衡浓度的取值范围是: 。
(4)若将2 mol SO2 (g)和1 mol O2 (g)充入容积可变的容器乙中,初始体积为2 L,达到平衡时放出热量Q kJ,则Q 178.2 kJ(填“>”,“=”或“<”)。
在2L密闭容器内,800℃时反应:2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间的变化如下表:
2NO2(g)体系中,n(NO)随时间的变化如下表:
| 时间(s) |
0 |
1 |
2 |
3 |
4 |
5 |
| n(NO)(mol) |
0.020 |
0.010 |
0.008 |
0.007 |
0.007 |
0.007 |
(1)NO的平衡浓度c(NO)= 。
(2)用O2表示从0~2s内该反应的平均反应速率v= 。
(3)下图中表示NO2变化的曲线是 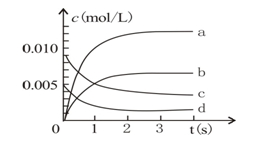
(4)800℃时,容器内起始压强和平衡后压强之比为___________________
(9分)研究NO2、SO2 、CO等大气污染气体的处理具有重要意义。
⑴NO2可用水吸收,相应的化学反应方程式为____________________________。利用反应6NO2+ 8NH3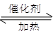 7N2+12 H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是 L。
7N2+12 H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是 L。
(2)已知:2SO2(g)+O2(g) 2SO3(g) ΔH=-196.6 kJ·mol-1
2SO3(g) ΔH=-196.6 kJ·mol-1
2NO(g)+O2(g) 2NO2(g) ΔH=-113.0 kJ·mol-1
2NO2(g) ΔH=-113.0 kJ·mol-1
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的ΔH= kJ·mol-1。
SO3(g)+NO(g)的ΔH= kJ·mol-1。
一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
a.体系压强保持不变
b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变
d.每消耗1 mol SO3的同时生成1 molNO2
测得上述反应平衡时NO2与SO2体积比为1:6,则平衡常数K= 。
(21分)恒温时,将2molA和2molB气体投入固定容积为2L密闭容器中发生反应:
2A(g) + B(g)  xC (g) + D(s) ,10s时,测得A的物质的量为1.7mol,C的反应速率为0.0225mol·L—1·s—1;40s时反应恰好处于平衡状态,此时B的转化率为20%。请填写下列空白:
xC (g) + D(s) ,10s时,测得A的物质的量为1.7mol,C的反应速率为0.0225mol·L—1·s—1;40s时反应恰好处于平衡状态,此时B的转化率为20%。请填写下列空白:
(1)x =
(2)从反应开始到40s达平衡状态,A的平均反应速率为
(3)平衡时容器中B的体积分数为
(4)该温度下此反应的平衡常数表达式为 数值是
(5)在相同温度下,若起始时c(A)="5" mol·L-1,c(B)=6mol·L-1,反应进行一段时间后,测得A的浓度为3mol·L-1,则此时该反应是否达到平衡状态 (填“是”与“否”),此时v(正) v(逆)(填“大于”“小于”或“等于”)。
在10L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g)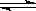 M(g)+N(g),所得实验数据如下表:
M(g)+N(g),所得实验数据如下表:
| 实验 编号 |
温度/℃ |
起始时物质的量/mol |
平衡时物质的量/mol |
|
| n(X) |
n(Y) |
n(M) |
||
| ① |
700 |
0.40 |
0.10 |
0.090 |
| ② |
800 |
0.10 |
0.40 |
0.080 |
| ③ |
800 |
0.20 |
0.30 |
a |
请计算:
(1)实验①中,若5min时测得n(M)=0.050mol,则0至5min时间内,用N表示的平均反应速率υ(N);
(2)实验②中,该反应的平衡常数K ;
(3)实验③中,达到平衡时,X的转化率 。
恒温下,将a mol N2与b mol H2的混合气体通入一个固定容积为2L的密闭容器中,发生如下反应:N2+ 3H2 2NH3。
2NH3。
(1)若反应进行5min时,测得n(N2) = 1.8mol,n(NH3) = 0.4mol。
计算:①a的值; ②用H2浓度的变化表示的反应速率。
(2)反应达平衡时,混合气体的总物质的量为5.0mol,其中NH3的含量(体积分数)为40%。
计算:上述温度下该反应的化学平衡常数。
在一定温度下,将2mol A和2molB 两种气体相混合于容积为2L的某密闭容器中,发生如下反应:3A(g)+B(g) xC(g)+2D(g),2min末反应达到平衡状态,生成了0.8mol D,并测得C的浓度为0.4 mol·L-1,试求:
xC(g)+2D(g),2min末反应达到平衡状态,生成了0.8mol D,并测得C的浓度为0.4 mol·L-1,试求:
(1)x值
(2)B的平衡浓度
(3)A的转化率
(4)用A表示的化学反应速率
氨是最重要的化工产品之一。
(1)合成氨用的氢气可以甲烷为原料制得。有关化学反应的能量变化如下图所示。
反应①②③为_________反应(填“吸热”或“放热”)。CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为__________________。
① ② ③
(2)用氨气制取尿素[CO(NH2)2]的反应为:2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(g)。
CO(NH2)2(l)+H2O(g)。
①某温度下,向容积为10L的密闭容器中通入2mol NH3和1molCO2,反应达到平衡时CO2的转化率为50%。该反应的化学平衡常数表达式为K=___________。该温度下平衡常数K的计算结果为____________。
②为进一步提高CO2的平衡转化率,下列措施中能达到目的的是_____________
| A.提高NH3的浓度 | B.增大压强 |
| C.及时转移生成的尿素 | D.使用更高效的催化剂 |
【原创】一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示,请回答下列问题: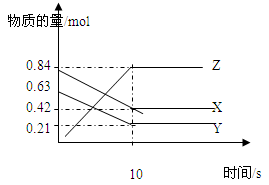
(1)反应的化学方程式。
(2)反应开始到10s,用X表示的反应速率为多少?
(3)Y的平衡转化率。
已知几种共价键的键能数据如下:
| 共价键 |
N≡N |
H-H |
N-H |
| 键能/(kJ·mol-1) |
946 |
436 |
390.8 |
⑴通过计算,写出合成氨反应的热化学方程式。
⑵某温度下,以1 mol N2和3mol H2作为初始反应物,在体积为2 L的恒容密闭容器中进行合成氨反应,达到平衡时测得反应放热68.1 kJ,试计算N2的转化率和该温度下的化学平衡常数。
在一定温度下,10L密闭容器中加入5molSO2、4.5molO2,经 10min后反应达平衡时有3molSO2发生了反应。试计算:
10min后反应达平衡时有3molSO2发生了反应。试计算:
1)用SO2表示该反应的反应速率为多少?
2)O2的转化率为多少?
3)平衡常数K为多少?
(10)向1L的恒容密闭容器中通入a mol气体A和a mol气体B,在一定条件下发生反应:xA(g)+yB(g)  pC(g)+qD(g)
pC(g)+qD(g)
已知:平均反应速率v(C)=0.5v(A);反应2 min时达到平衡,A的浓度减少了一半,B的物质的量减少了0.5amol,有0.75a mol D生成。回答下列问题:
(1)反应2 min内,vA=________________;
(2)请写出该反应的化学方程式:________________________________;
(3)反应达平衡时,B的转化率为________;
(4)下列能说明该反应到达平衡的是________________;
A.容器内的总压强不再变化
B.容器内气体的平均相对分子质量不再变化
C.容器内气体的密度不再变化
D.容器内D的质量不再变化
(5)计算该反应的化学平衡常数________________。
(8分) 将N2和 H2按一定比例混合,在相同状况下其密度是H2的3.6倍,取0.5 mol该混合气体通入密闭容器内,使之发生反应,并在一定条件下达到平衡,已知反应达到平衡后容器内压强是相同条件下反应前压强的0.76倍。试求:
(1)反应前混合气体中N2和 H2的体积比。
(2)达平衡时混合气体中氨的物质的量。
恒温下,将xmolN2与ymolH2的混合气体通入一个容积为1L的密闭容器中,发生如下反应:N2(g)+3H2(g) 2NH3(g)。
2NH3(g)。
(1)若反应到达某时刻t时,nt(H2)=9mol,nt(NH3)=4mol,计算y的值。
(2)反应达平衡时,混合气体的体积为672L(标准状况下),其中NH3的含量(体积分数)为20%,计算平衡时NH3的物质的量及平衡常数K(保留2位有效数字)。
已知可逆反应:M(g)+N(g) P(g)+Q(g),△H>0请回答下列问题:
P(g)+Q(g),△H>0请回答下列问题:
(1)在某温度下,反应物的起始浓度分别为:c(M)=" 1" mol·L-1,c(N)=2.4 mol·L-1,达到平衡后,M的 转 化率为60%,此时N的转化率为_________________;
(2)若反应温度升高,M的转化率_____________________(填“增大”“减小”或“不变”);
(3)若反应温度不变,反应物的起始浓度分别为:c(M)= 4mol·L-1, c(N)="a" mol·L-1,达到平衡后,c(P)="2" mol·L-1,则a为多少?
(4)若反应温度不变,反应物的起始浓度为:c(M)= c(N)=" b" mol·L-1,达到平衡后,M的转化率为多少?(已知, )备注:(3)(4)写计算过程
)备注:(3)(4)写计算过程
试题篮
()