某温度下,在装有催化剂的容积为2 L的反应容器中,充入SO2和O2各4 mol ,充分反应5 min后达到平衡,测得反应容器内混合气体的压强为原来的80 %。回答下列问题:
(1)用O2的浓度变化表示该反应的化学反应速率。
(2)求SO2的转化率。
(3)求该反应的平衡常数。
已知2SO2(g)+ O2(g) 2SO3(g) △H<0,温度一定,体积为3L的密闭容器中,投入2 mol SO2和1 molO2,2min反应达平衡时,容器中有1.2 mol SO3,放出热量118.2kJ,试计算:
2SO3(g) △H<0,温度一定,体积为3L的密闭容器中,投入2 mol SO2和1 molO2,2min反应达平衡时,容器中有1.2 mol SO3,放出热量118.2kJ,试计算:
(要求写计算过程)
(1)写出该反应的热化学方程式。
(2)该反应中SO2的转化率是多少?
(3)反应2分钟,以O2表示的平均反应速率为多少?
(4)计算达平衡后SO2的质量分数为多少?
将4mol SO2与2molO2放入4L的密闭容器中,在一定条件下反应达到平衡: 2SO2+O2
2SO2+O2 2SO3,测得平衡时SO3的浓度为0.5mol/L,求:
2SO3,测得平衡时SO3的浓度为0.5mol/L,求: (1)平衡时各反应物的浓度;
(1)平衡时各反应物的浓度; (2)平衡时SO2的转化率;
(2)平衡时SO2的转化率; (3)该条件下的平衡常数K
(3)该条件下的平衡常数K
碳及其化合物有广泛的用途。
(1)将水蒸气通过红热的碳即可产生水煤气。反应为:
C(s)+ H2O(g)  CO(g) +H2(g) ΔH=" +131.3" kJ•mol-1,以上反应达到平衡后,在体积不变的条件下,以下措施有利于提高H2O的平衡转化率的是 。(填序号)
CO(g) +H2(g) ΔH=" +131.3" kJ•mol-1,以上反应达到平衡后,在体积不变的条件下,以下措施有利于提高H2O的平衡转化率的是 。(填序号)
| A.升高温度 | B.增加碳的用量 | C.加入催化剂 | D.用CO吸收剂除去CO |
(2)又知,C(s)+ CO2(g) 2CO(g) △H=+172.5kJ•mol-1
2CO(g) △H=+172.5kJ•mol-1
则CO(g)+H2O(g) CO2(g)+H2(g)的焓变△H=
CO2(g)+H2(g)的焓变△H=
(3)CO与H2在一定条件下可反应生成甲醇,CO(g)+2H2(g) CH3OH(g)。甲醇是一种燃料,可利用甲醇设计一个燃料电池,用稀硫酸作电解质溶液,多孔石墨做电极,该电池负极反应式为: 。
CH3OH(g)。甲醇是一种燃料,可利用甲醇设计一个燃料电池,用稀硫酸作电解质溶液,多孔石墨做电极,该电池负极反应式为: 。
若用该电池提供的电能电解60mL NaCl溶液,设有0.01molCH3OH完全放电,NaCl足量,且电解产生的Cl2全部溢出,电解前后忽略溶液体积的变化,则电解结束后所得溶液的pH=
(4)将一定量的CO(g)和H2O(g)分别通入到体积为2.0L的恒容密闭容器中,发生以下反应: CO(g)+H2O(g) CO2(g)+H2(g),得到如下数据:
CO(g)+H2O(g) CO2(g)+H2(g),得到如下数据:
| 温度/℃ |
起始量/mol |
平衡量/mol[学科 |
达到平衡所x需时间/min |
||
| H2O |
CO |
H2 |
CO |
||
| 900 |
1.0 |
2.0 |
0.4 |
1.6 |
3.0 |
通过计算求出该反应的平衡常数(结果保留两位有效数字) 。
改变反应的某一条件,反应进行到tmin时,测得混合气体中CO2的物质的量为0.6 mol。若用200 mL 5 mol/L的NaOH溶液将其完全吸收,反应的离子方程式为(用一个离子方程式表示) 。
(5)工业生产是把水煤气中的混合气体经过处理后获得的较纯H2用于合成氨。合成氨反应原理为:N2(g)+3H2(g)  2NH3(g) ΔH=-92.4kJ•mol-1。实验室模拟化工生产,分别在不同实验条件下反应,N2浓度随时间变化如下图。
2NH3(g) ΔH=-92.4kJ•mol-1。实验室模拟化工生产,分别在不同实验条件下反应,N2浓度随时间变化如下图。
不同实验条件下反应,N2浓度随时间变化如下图1。

图1 图2
请回答下列问题:
①与实验Ⅰ比较,实验Ⅱ改变的条件为 。
②实验Ⅲ比实验Ⅰ的温度要高,其它条件相同,请在上图2中画出实验Ⅰ和实验Ⅲ中NH3浓度随时间变化的示意图。
一定条件下1molN2和4mol H2通入到V升的容器中发生反应,反应前容器中的压强为P,保持温度和体积不变,10min后反应达到平衡,此时容器内混合气体平均相对分子质量为9,试求
(1)平衡时,体系内压强为多少?
(2)平衡时,氨气的体积分数为多少?
一定温度下的密闭容器中存在如下反应:CO(g) + H2O(g)  CO2(g) + H2(g),已知CO(g)和H2O(g)的起始浓度均为2mol·L-1,经测定该反应在该温度下的平衡常数K=1,试判断:
CO2(g) + H2(g),已知CO(g)和H2O(g)的起始浓度均为2mol·L-1,经测定该反应在该温度下的平衡常数K=1,试判断:
(1) 当CO转化率为25%时,该反应是否达到平衡,若未达到,向哪个方向进行?
(2)当CO的起始浓度仍为2mol·L-1,H2O(g)的起始浓度为6mol·L-1,求平衡时CO的转化率?
甲醇被称为2l世纪的新型燃料,工业上通过下列反应Ⅰ和Ⅱ,用CH4和H2O为原料来制备甲醇:
CH4(g)+H2O(g) CO(g)+3H2(g)……Ⅰ CO(g)+2H2(g)
CO(g)+3H2(g)……Ⅰ CO(g)+2H2(g) CH3OH(g) ……Ⅱ。
CH3OH(g) ……Ⅱ。
(1)将1.0 mol CH4和2.0 mol H2O(g)通入容积为100L反应室,在一定条件下发生反应I,CH4的平衡转化率与温度、压强的关系如图。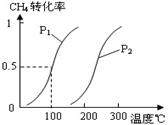
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为 。
②图中的P1 P2(填“<”、“>”或“=”),100℃时平衡常数的值为 。
(2)在压强为0.1 MPa条件下, 将a mol CO与 3a mol H2的混合气体在催化剂作用下,自发反应Ⅱ,生成甲醇。
③该反应的△H 0;若容器容积不变,下列措施可增加甲醇产率的是 。
| A.升高温度 | B.将CH3OH(g)从体系中分离 |
| C.充入He,使体系总压强增大 | D.再充入1mol CO和3mol H2 |
④为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
| 实验编号 |
T(℃) |
n(CO)/n(H2) |
P(Mpa) |
| i |
150 |
1/3 |
0.1 |
| ii |
|
|
5 |
| iii |
350 |
|
5 |
a.请在上表空格中填入剩余的实验条件数据。
b.根据反应Ⅱ的特点,在给出的坐标图中,补画出在5MPa条件下CO的转化率随温度变化的趋势曲线示意图,并标明压强。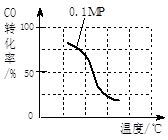
消除汽车尾气是减少城市空气污染的热点研究课题。
(1)汽车内燃机工作时发生的反应N2(g) + O2(g) 2NO(g),生成的NO是汽车尾气的主要污染物。T ℃时,向5L密闭容器中充入6.5 molN2和7.5 molO2,在5 min时反应达到平衡状态,此时容器中NO的物质的量是5 mol(不考虑后续反应)。则:
2NO(g),生成的NO是汽车尾气的主要污染物。T ℃时,向5L密闭容器中充入6.5 molN2和7.5 molO2,在5 min时反应达到平衡状态,此时容器中NO的物质的量是5 mol(不考虑后续反应)。则:
①5 min内该反应的平均速率ν(NO) = ;在T ℃时,该反应的平衡常数K = 。
② 反应开始至达到平衡的过程中,容器中下列各项发生变化的是 (填序号)。
a.混合气体的密度 b.混合气体的压强
c.正反应速率 d.单位时间内,N2和NO的消耗量之比
(2)用H2或CO催化还原NO可以达到消除污染的目的。
已知:2NO(g) = N2(g) + O2(g) △H =" —180.5" kJ·mol-1
2H2O(l) =2H2(g) + O2(g) △H =" +571.6" kJ·mol-1
则H2(g)与NO(g)反应生成N2(g)和H2O(l)的热化学方程式是
。
(3)当质量一定时,增大固体催化剂的表面积可提高化学反应速率。下图表示在其他条件不变时,反应2NO(g) + 2CO(g)
 2CO2(g) + N2(g) 中,NO的浓度[c(NO)]随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。
2CO2(g) + N2(g) 中,NO的浓度[c(NO)]随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。
① 该反应的H 0 (填“>”或“<”)。
②若催化剂的表面积S1>S2 ,在右图中画出c(NO) 在T1、 S2 条件下达到平衡过程中的变化曲线(并作相应标注)。
在密闭容器中充入A(g)和B(g),它们的初始浓度均为2mol•L﹣1,在一定条件下发生反应:A(g)+B(g)⇌2C(g),该温度下,此反应的平衡常数为4,则A的转化率为多少?
CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g) ΔH=−867 kJ·mol-1。该反应可用于消除氮氧化物的污染。在130℃和180℃时,分别将0.50 molCH4和a molNO2充入1L的密闭容器中发生反应,测得有关数据如下表:
N2(g)+CO2(g)+2H2O(g) ΔH=−867 kJ·mol-1。该反应可用于消除氮氧化物的污染。在130℃和180℃时,分别将0.50 molCH4和a molNO2充入1L的密闭容器中发生反应,测得有关数据如下表:
| 实验编号 |
温度 |
时间 |
0 |
10 |
20 |
40 |
50 |
| 1 |
130℃ |
n(CH4)/mol |
0.50 |
0.35 |
0.25 |
0.10 |
0.10 |
| 2 |
180℃ |
n(CH4)/mol |
0.50 |
0.30 |
0.18 |
|
0.15 |
(1)开展实验1和实验2的目的是 。
(2)180℃时,反应到40min,体系 (填“是”或“否”)达到平衡状态,理由是 ;CH4的平衡转化率为 。
(3)已知130℃时该反应的化学平衡常数为6.4,试计算a的值。(写出计算过程)
(4)一定条件下,反应时间t与转化率μ(NO2)的关系如图所示,请在图像中画出180℃时,压强为P2(设压强P2>P1)的变化曲线,并做必要的标注。
(5)根据已知求算:ΔH2= 。
CH4(g)+4NO2(g) 4NO(g)+CO2(g)+2H2O(g) ΔH1=−574 kJ·mol-1
4NO(g)+CO2(g)+2H2O(g) ΔH1=−574 kJ·mol-1
CH4(g)+4NO(g) 2N2(g)+CO2(g)+2H2O(g) ΔH2
2N2(g)+CO2(g)+2H2O(g) ΔH2
“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视。所以“低碳经济”正成为科学家研究的主要课题。
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式,并在方框内填上系数。
□C+□KMnO4+□H2SO4 =□CO2↑+□MnSO4 +□K2SO4+□
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g) CO2(g)+H2(g),得到如下二组数据:
CO2(g)+H2(g),得到如下二组数据:
| 实验组 |
温度℃ |
起始量/mol |
平衡量/mol |
达到平衡所需时间/min |
||
| CO |
H2O |
H2 |
CO |
|||
| 1 |
650 |
4 |
2 |
1.6 |
2.4 |
6 |
| 2 |
900 |
2 |
1 |
0.4 |
1.6 |
3 |
①实验1条件下,反应从开始至达到平衡,以v(CO2)表示的平均反应速率为 (保留小数点后二位数,下同)。
②实验2条件下平衡常数K=____ _____,该反应为 (填“吸热”或“放热”)反应。
(3)已知在常温常压下:
① 2CH3OH(l) +3O2(g)=2CO2(g)+4H2O(g) ΔH1=-1275.6 kJ/mol
② 2CO (g)+ O2(g)=2CO2(g) ΔH2=-566.0 kJ/mol
③ H2O(g)=H2O(l) ΔH3=-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和气态水的热化学方程式: 。
(4)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置。 
①该电池正极的电极反应式为: ;
②该电池工作时,溶液中的OH-向______(填“正”或“负”)极移动。
㈠已知:2H2 ( g ) + O2 ( g ) = 2H2O ( l ); △H = -571.6kJ/mol
CH4 ( g ) + 2O2 ( g ) = 2H2O ( l ) + CO2 ( g ); △H = -890 kJ/mol
标准状况下,取甲烷和氢气的混合气体11.2 L完全燃烧后恢复到常温,则放出的热量为203.32kJ,试求混合气体中甲烷和氢气体积比。
(二)在一定条件下,在容积为2L的密闭容器中,将2mol气体M和3mol气体N混合,发生如下反应:2M(g)+ 3N(g) Q(g)+3R(g),经2min达平衡,生成2.4molR,并测得Q的浓度为0.4mol/L。求:
Q(g)+3R(g),经2min达平衡,生成2.4molR,并测得Q的浓度为0.4mol/L。求:
(1)用气体M来表示该反应的化学反应速率是多少?
(2)反应前后的压强比?
(3)N的转化率是多少?
(4)平衡时气体Q所占的体积分数为多少?
恒温下,将a molN2与b molH2的混合气体通入10L 固定容积的密封容器中,发生如下反应:
N2(g) +3H2(g) 2NH3(g)
2NH3(g)
(1)若反应进行到10 min时,n (N2) =" 10" mol,n (NH3) =" 6" mol,计算a的值以及用氢气表示的反应的平均速率。
(2)反应达平衡时,混合气体的体积为716.8 L(标准状况下),其中所含氨气的体积分数为25%,计算平衡时氨气的物质的量以及氢气的转化率。
(11分)恒温、恒压的条件下,将N2和H2按体积比1:3混合充入一密闭容器中,发生下列反应 N2 + 3 H2 2NH3,达平衡时,测得气体体积为起始气体体积的0.75倍,求:(1)平衡时N2的转化率;
2NH3,达平衡时,测得气体体积为起始气体体积的0.75倍,求:(1)平衡时N2的转化率;
(2)平衡时混合气体中NH3的体积分数;
(3)平衡时混合气体的相对分子质量与起始气体的相对分子质量之比.
(请写出计算过程)
“温室效应”是全球关注的环境问题之一。CO2是目前大气中含量最高的一种温室气体。因此,控制和治理CO2是解决温室效应的有效途径。
(1)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g) CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
| 实验组 |
温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡所需时间/min |
||
| CO |
H2O |
H2 |
CO |
|||
| 1 |
650 |
4 |
2 |
1.6 |
2.4 |
6 |
| 2 |
900 |
2 |
1 |
0.4 |
1.6 |
3 |
| 3 |
900 |
a |
b |
c |
d |
t |
① 实验1条件下平衡常数K= (保留小数点后二位数字)。
② 实验3中,若平衡时,CO的转化率大于水蒸气,则a/b 的值 (填具体值或取值范围)。
③ 实验4,若900℃时,在此容器中加入10molCO、5molH2O、2molCO2、5molH2,则此时v(正) v(逆)(填“<”、“>”、“=”)。
(2)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10—9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10—4mo1/L,则生成沉淀所需CaCl2溶液的最小浓度为 。
(3)已知BaSO4(s) + 4C(s) ="4CO(g)" + BaS(s) △H1 =+571.2kJ/mol,
BaSO4(s) + 2C(s) = 2CO2(g) + BaS(s) △H2="+226.2" kJ/mol。
则反应C(s) + CO2(g) = 2CO(g)的△H3= kJ/mol。 (4)寻找新能源是解决温室效应的一条重要思路。磷酸亚铁锂LiFePO4是一种新型汽车锂离子电池,总反应为:FePO4+Li LiFePO4,电池中的固体电解质可传导Li+,则该电池放电时的正极和负极反应式分别为: 和 。若用该电池电解蒸馏水(电解池电极均为惰性电极),当电解池两极共有3360mL气体(标准状况)产生时,该电池消耗锂的质量为 。(Li的相对原子质量约为7.0)
(4)寻找新能源是解决温室效应的一条重要思路。磷酸亚铁锂LiFePO4是一种新型汽车锂离子电池,总反应为:FePO4+Li LiFePO4,电池中的固体电解质可传导Li+,则该电池放电时的正极和负极反应式分别为: 和 。若用该电池电解蒸馏水(电解池电极均为惰性电极),当电解池两极共有3360mL气体(标准状况)产生时,该电池消耗锂的质量为 。(Li的相对原子质量约为7.0)
试题篮
()