甲醇是一种可再生能源,在日常生活中有着广泛的应用.工业上用CO生产燃料甲醇,如:CO(g)+2H2(g)⇌CH3OH(g).图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化.
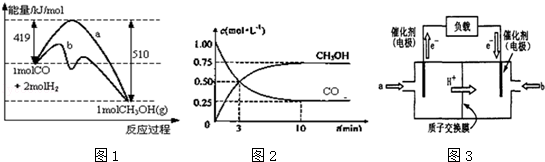
请回答下列问题:
(1)图1表示使用和未使用催化剂时反应过程和能量的对应关系.下列有关催化剂的说法不正确是
| A.降低分子的能量 | B.增加了活化分子数 |
| C.提高了活化分子百分数 | D.增加了单位体积内的活化分子数 |
(2)从反应开始到建立平衡,该过程中释放 kJ热量.
(3)在T2℃下,将2molCO和6molH2充入2L的密闭容器中,达到平衡状态时,测得c(CO)=0.2mol•L﹣1,则CO的转化率为 .
(4)如图3为常用笔记本电脑所用甲醇质子交换膜燃料电池的结构示意图如.电池总反应为2CH3OH+3O2⇌2CO2+4H2O.在电脑的使用过程中,电池的温度往往因为各种原因会升高.温度升高_____________(填:“有利于”或“不利于”)电池将化学能转化为电能.该装置中___________(填:“a”或“b”)为电池的负极,该电极反应式为 .
在2L密闭容器内,800℃时反应:2NO(g)+O2(g) 2NO2(g)。体系中,n(NO)随时间的变化如表:
2NO2(g)。体系中,n(NO)随时间的变化如表:
| 时间(s) |
0 |
1 |
2 |
3 |
4 |
5 |
| n(NO)(mol) |
0.020 |
0.01. |
0.008 |
0.007 |
0.007 |
0.007 |
(1)写出该反应的平衡常数表达式:K= 。
已知: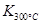 >
>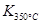 ,则该反应是 热反应。
,则该反应是 热反应。
(2)图中表示NO2的变化的曲线是 。
用O2表示从0~2 s内该反应的平均速率v= 。
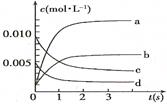
(3)能说明该反应已达到平衡状态的是 。
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是 。
a.及时分离除NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
某温度时,在2L容器中X、Y、Z三种气体物质的物质的量(n)随着时间(t)变化的曲线如图所示.由图中数据分析:

(1)该反应的化学方程式为______
(2)反应开始至2min,用Z表示的平均反应速率为______
某温度时,在VL密闭容器中,A、B、C三种物质的物质的量随时间变化的曲线如图所示,由图中数据分析:
(1)反应的化学方程式为__________________。
(2)从开始到t1 min末时,用物质C表示的反应速率为____________________。
一定温度下在10L容器中加入5molSO2和3molO2,当反应达到平衡时,有3molSO2发生反应。
(1)生成了 molSO3,SO2的转化率为 。
(2)平衡时容器内气体的总物质的量为 mol。
(3)平衡时SO2的浓度是 mol/L。
将6molA气体和2molB气体在2L密闭容器中混合并在一定条件下发生反应:3A(g)+B(g) xC(g)+2D(g)。若经5min后反应达到平衡状态,容器内的压强变小,并知D的平均反应速率为0.2mol/(L•min),请填写下列空白:
xC(g)+2D(g)。若经5min后反应达到平衡状态,容器内的压强变小,并知D的平均反应速率为0.2mol/(L•min),请填写下列空白:
①x的数值为 ; ②A的平均反应速率为 ; ③5min时B的转化率为 。
将6molA气体和2molB气体在2L密闭容器中混合并在一定条件下发生反应:3A(g)+B(g) xC(g)+2D(g)。若经5min后反应达到平衡状态,容器内的压强变小,并知D的平均反应速率为0.2mol/(L•min),请填写下列空白:
xC(g)+2D(g)。若经5min后反应达到平衡状态,容器内的压强变小,并知D的平均反应速率为0.2mol/(L•min),请填写下列空白:
①x的数值为 ; ②A的平均反应速率为 ; ③5min时B的转化率为 。
某温度时,在一个2 L的密闭容器中,X、Y、Z三种气体物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白: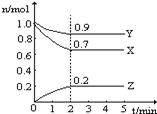
(1)该反应的化学方程式为 ______ __ 。
(2)该反应是由 开始的。(①正反应 ②逆反应 ③正逆反应同时。)
(3)该反应第 ______ 分钟到达平衡状态。
(4)反应开始至3 min,气体X的平均反应速率为 _______。
汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体相互反应转化为无毒气体。汽车尾气中CO与H2O(g)在一定条件下可以发生反应:
CO(g)+H2O(g) CO2(g)+H2(g)ΔH<0。820 ℃时在甲、乙、丙三个恒容密闭容器中,起始时按照下表进行投料,达到平衡状态,K=1.0。
CO2(g)+H2(g)ΔH<0。820 ℃时在甲、乙、丙三个恒容密闭容器中,起始时按照下表进行投料,达到平衡状态,K=1.0。
| 起始物质的量 |
甲 |
乙 |
丙 |
| n(H2O)/mol |
0.10 |
0.20 |
0.20 |
| n(CO)/mol |
0.10 |
0.10 |
0.20 |
(1)该反应的平衡常数表达式为 。
(2)平衡时,甲容器中CO的转化率是 。比较下列容器中CO的转化率:乙 甲;丙 甲(填“>”、“=”或“<”)。
(3)丙容器中,若要通过改变温度,使CO的平衡转化率增大,则温度需要降低才能达到,则降温后的平衡常数K (填“增大”、“减小”或“不变”)。
某温度时,在2 L容器中A、B两种物质间的转化反应中,A、B物质的量随时间变化的曲线如图所示,由图中数据分析得:
(1)该反应的化学方程式为_________________________________________。
(2)反应开始至4 min时,A的平均反应速率为________________________________。
(3)4 min时,反应是否达到平衡状态?________(填“是”或“否”),8 min时,v(正)________v(逆)(填“>”、“<”或“=”)。
(1)在某容积不变的密闭容器中,有可逆反应:mA(g)+nB(g) pC(g)+qD(s)△H<0如图某反应过程中各物质物质的量n(mol)随时间t的变化曲线图。
pC(g)+qD(s)△H<0如图某反应过程中各物质物质的量n(mol)随时间t的变化曲线图。
①该反应的平衡常数表达式为(各物质浓度的指数用数值表示): 。
②若充入A,K值 (填一定增大、一定减小、或可能增大也可能减小、不变);正反应速率____(填增大、减小、不变)。
③若体积为10升的密闭容器中,500℃、有催化剂存在的条件下,根据图示回答下列问题:在0~15min内的平均反应速率:v(B)=
(2)对于某可逆反应:A(g)+B(g) 2C(g)△H<0。若该反应的正反应速率与时间的关系如图所示。在其它条件不变的情况下,请填空:
2C(g)△H<0。若该反应的正反应速率与时间的关系如图所示。在其它条件不变的情况下,请填空:
①写出t2时改变的条件可能是: (用文字表达);
②t4时改交的条件可能是 (用编号表示,多选扣分)
A.增大压强 B.减小压强
C.使用催化剂 D.升高温度
E.增大A的浓度
某温度时,在2L容器中X、Y、Z三种气体物质的量随时间的变化关系曲线如图(2)所示。
(1)由图中的数据分析,该反应的化学方程式为 。
(2)反应开始至5min,Z的平均反应速率为 ;
(3)反应开始至5min ,正反应速率逐渐 ;逆反应速率逐渐 , 5min后Z的物质的量不再改变,原因是下列的 ;
A.正逆反应都停止了
B.正反应速率为零
C.正逆反应速率相等,反应达到平衡状态
D.逆反应速率为零
(4)下列措施能使正反应速率增大的是
A.升高温度 B.降低温度
C.增大Y的浓度 D.减少Z的浓度
(14分)FeCl3在选修四中出现的次数较多,可见其重要性.
(1)在演示催化剂对化学反应速率的影响实验中,向H2O2溶液中分别滴入FeCl3溶液和CuSO4溶液,催化效果更好的是________ (1分),画出无催化剂和有催化剂的能量-反应进程对比图,并作必要的文字注明(3分)
(2)在演示增加反应物浓度对化学平衡的影响实验中,稀FeCl3溶液与稀KSCN溶液混合,溶液呈较浅血红色。将该浅血红色分成两等份,分别加入同浓度的FeCl3溶液和稀KSCN溶液,红色变得更深的是________(1分), 从化学平衡常数的角度加以分析(3分)(温度不变,假设后加入的FeCl3溶液和稀KSCN溶液都是各自起始浓度的10倍)(3分)
(3)分别取若干毫升稀FeCl3溶液与稀KSCN溶液混合,溶液呈较浅血红色。限用FeCl3、KSCN、 KCl三种化学药品,为证明FeCl3溶液与KSCN溶液的反应是一个可逆反应,至少还要进行( )次实验。
| A.1 | B.2 | C.3 | D.4 |
(4)实验室配制和保存FeCl3溶液,要向其中加入________,防止其水解变质。
(5)0.1mol·L-1 FeCl3溶液中的c(Fe3+) 比0.1mol·L-1 (NH4)Fe(SO4)2溶液中的c(Fe3+)______.
(1)在 H,
H, H,
H, H,
H, Mg,
Mg, Mg,
Mg, O,
O, O,
O, O中共有______种元素,______种原子,中子数最多的是 。D218O的相对分子质量是______。
O中共有______种元素,______种原子,中子数最多的是 。D218O的相对分子质量是______。
(2)人类的生活和生产活动,都离不开能源。在石油、电能、风能、煤碳、天然气、秸杆、水力、水煤气这些能源中,属于“二次能源”的(两种)是____,_ (共1分)属于“不再生能源”的(三种)是___ , , _(共1分)。
(3)化学反应的限度是当_ _____和 __相等,反应物和生成物的 _ ____保持不变时,所达到的一种看似 的“平衡状态”。
在2 密闭容器内,800 ℃时反应:

,
体系中,
随时间的变化如表:
| 时间( |
0 |
1 |
2 |
3 |
4 |
5 |
| 0.020 |
0.010 |
0.008 |
0.007 |
0.007 |
0.007 |
(1)用表示从0~2
内该反应的平均速率
。
 (2)右图中表示
(2)右图中表示浓度的变化的曲线是。
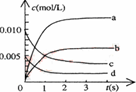
(3)能说明该反应已达到平衡状态的是。
A. B.容器内压强保持不变
C.逆
=2
正
D.容器内密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是。
A.及时分离除气体 B.适当升高温度
C.增大的浓度 D.选择高效催化剂
试题篮
()