在一定条件下,反应3A(g) + B  2C +2D达到平衡
2C +2D达到平衡
(1)若升高温度,平衡向正反应方向移动,则逆反应是___________(填“吸热”或“放热”)反应,逆反应速率____________(填“增大”或“不变”或“变小”)
(2)若增加或减少B时,平衡不移动,则B是__________态。
(3)若增大压强,平衡向逆反应方向移动,则可判断:B是___态,C是___态,D是__态
已知 :N2(g)+3H2(g)  2NH3(g) ΔH=-92 kJ·mol-1。
2NH3(g) ΔH=-92 kJ·mol-1。
(1) 在500℃、2.02×107Pa和铁催化条件下2L密闭容器中充入1molN2和3mol H2,10 min时达到平衡,有0.2 mol NH3生成,则10 min内用氢气表示的该反应的平均速率v(H2)为 ,H2的转化率为__________。
(2)充分反应后,放出的热量______(填“<”“>”“=”)92.4kJ,理由是
 。
。
(3)为有效提高氢气的转化率,实际生产中宜采取的措施有____________
| A.降低温度 | B.不断补充氮气 | C.恒容下充入He来增大压强 |
| D.升高温度 E.原料气不断循环 F.及时移出氨 |
(4)氨催化氧化制NO在热的铂铑(Pt-Rh)合金催化下进行,反应过程中合金始终保持红热,该反应的化学平衡常数K的表达式为________________ ,当升高温度时,K值______(填“增大”、“减小”、“不变”)。NH3转化率在温度T1下随反应时间(t)的变化如右图:其他条件不变,仅改变温度为T2(T2大于T1),在答题卡框图中画出温度T2下NH3转化率随反应时间变化的预期结果示意图。
(10分)下图是某温度下,在2L容器中某可逆反应X、Y、Z三种物质的浓度与时间的关系图,根据图中信息回答下列问题:
(1)由图中的数据分析,该反应的化学方程式为 ;
(2)用X表示的化学反应速率为 mol/(L·min),如果升高温度,达到平衡时的时间会变 (填长、短、不能确定或不变)
(3)5min后Z的生成速率 5min时Z的生成速率(填大于、小于或等于)。
(4)达到平衡时X的转化率为 ;
在一定温度下的2 L密闭容器中充入0.4 mol SO2和0.2 mol O2 ,发生反应:2SO2(g)+O2(g)  2SO3(g) ΔH <0,n(O2)随时间的变化如图实线所示:
2SO3(g) ΔH <0,n(O2)随时间的变化如图实线所示: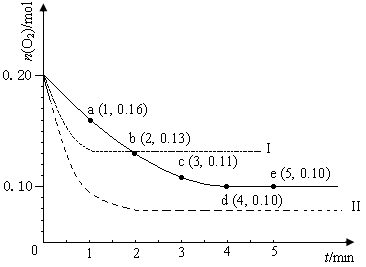
(1)用SO2表示0~4 min内该反应的平均速率为 。该温度下反应的平衡常数K为 。升高温度K值 (填“增大”、“不变”或“减小”)。
(2)若温度不变,在容器中再加1 mol O2 ,重新达到平衡,则SO2的平衡浓度
(填“增大”、“不变”或“减小”),氧气的转化率 (填“升高”、“不变”或“降低”),SO3的体积分数 (填“增大”、“不变”或“减小”)。
(3)仅改变某一实验条件再进行两次实验,测得O2的物质的量随时间变化如图中虚线所示,曲线I对应的实验条件改变是_____________________________,曲线II对应的实验条件改变是______________________________________。
在溶液中,反应A+2B C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)="0.100" mol/L、c(B)="0.200" mol/L及c(C)="0" mol/L。反应物A的浓度随时间的变化如下图所示。
C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)="0.100" mol/L、c(B)="0.200" mol/L及c(C)="0" mol/L。反应物A的浓度随时间的变化如下图所示。
请回答下列问题:
(1)与①比较,②和③分别仅改变一种反应条件。所改变的条件是:②_______________;③_______________。
(2)实验②平衡时B的转化率为_________;实验③平衡时C的浓度为____________。
(3)该反应的正反应是 (填“放热”或“吸热”)反应。
(4)实验③前10.0 min内平均反应速度率vB=__________________。
目前工业上有一种方法是用CO2来生产燃料甲醇。
CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-49.0kJ/mol,为探究反应原理,现进行如下实验:
CH3OH(g)+H2O(g) ΔH=-49.0kJ/mol,为探究反应原理,现进行如下实验:
在体积为1 L的密闭容器中,充入1mol CO2和4 mol H2,一定条件下发生反应:测得CO2和CH3OH(g)的浓度随时间变化如图所示。
(1)从反应开始到平衡,氢气的平均反应速率v(H2)= mol/(L·min)。
(2)该反应的平衡常数表达式为 。
(3)下列措施中能使n(CH3OH)/n(CO2)增大的是 。
A.升高温度 |
B.充入He(g),使体系压强增大 |
| C.将H2O(g)从体系中分离 | D.再充入1 mol CO2和4 mol H2 |
(4)如果在相同的容器中事先充入1 mol CH3OH和1 mol H2O,为了使反应达到的化学平衡和上述一样,则起始还需加入H2的物质的量为 。
mol CH3OH和1 mol H2O,为了使反应达到的化学平衡和上述一样,则起始还需加入H2的物质的量为 。
(7分)某温度时,在2L密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示。由图中数据分析:
(1)该反应的化学方程式为: ;
(2)反应开始至2min末,X的反应速率为 (mol·L-1·min-1);
(3)3min后图中曲线所表示的含义是: 。
甲醇是一种可再生能源,在日常生活中有着广泛的应用.工业上用CO生产燃料甲醇,如:CO(g)+2H2(g)⇌CH3OH(g).图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化.
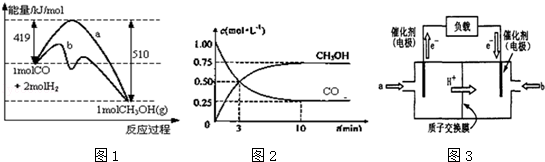
请回答下列问题:
(1)图1表示使用和未使用催化剂时反应过程和能量的对应关系.下列有关催化剂的说法不正确是
| A.降低分子的能量 | B.增加了活化分子数 |
| C.提高了活化分子百分数 | D.增加了单位体积内的活化分子数 |
(2)从反应开始到建立平衡,该过程中释放 kJ热量.
(3)在T2℃下,将2molCO和6molH2充入2L的密闭容器中,达到平衡状态时,测得c(CO)=0.2mol•L﹣1,则CO的转化率为 .
(4)如图3为常用笔记本电脑所用甲醇质子交换膜燃料电池的结构示意图如.电池总反应为2CH3OH+3O2⇌2CO2+4H2O.在电脑的使用过程中,电池的温度往往因为各种原因会升高.温度升高_____________(填:“有利于”或“不利于”)电池将化学能转化为电能.该装置中___________(填:“a”或“b”)为电池的负极,该电极反应式为 .
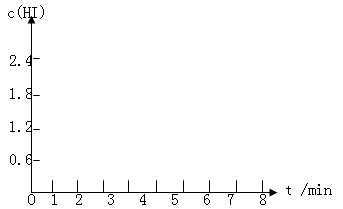
将0.8 mol I2(g)和1.2 mol H2(g)置于某1L密闭容器中,在一定温度下发生反应:I2(g)+H2(g)  2HI(g)并达到平衡。HI的体积分数随时间的变化如表格所示:
2HI(g)并达到平衡。HI的体积分数随时间的变化如表格所示:
| HI体积分数 |
1min |
2min |
3min |
4min |
5min |
6min |
7min[ |
| 条件I |
26% |
42% |
52% |
57% |
60% |
60% |
60% |
| 条件II |
20% |
33% |
43% |
52% |
57% |
65% |
65% |
(1)在条件I到达平衡时,计算该反应的平衡常数K,要求列出计算过程。
(2)在条件I从开始反应到到达平衡时,H2的反应速率为____________。
(3)为达到条件II的数据,对于反应体系可能改变的操作是_______________。
(4)该反应的△H__________0(填">","<"或"=")
(5)在条件I下达到平衡后,在7min时将容器体积压缩为原来的一半。请在图中画出c(HI)随时间变化的曲线。
FeCl3具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3高效,且腐蚀性小。请回答下列问题:
(1)FeCl3净水的原理是(用离子方程式表示) 。FeCl3溶液腐蚀钢铁设备,除H+作用外,另一主要原因是(用离子方程式表示) 。
(2)为节约成本,工业上用NaClO3氧化酸性FeCl2废液得到FeCl3。
①若酸性FeCl2废液中c(Fe2+)=2.0×10-2mol·L-1,c(Fe3+)=1.0×10-3mol·L-1,
c(Cl-)=5.3×10-2mol·L-1,则该溶液的PH约为 。
②完成NaClO3氧化FeCl2的离子方程式:
□ClO3―+□Fe2++□ =□Cl―+□Fe3++□ 。
(3)生成聚合氧化铁的离子方程式为:xFe3++yH2O Fex(OH)y(3x-y)++yH+ 欲使平衡正向移动可采用的方法是(填序号) 。
Fex(OH)y(3x-y)++yH+ 欲使平衡正向移动可采用的方法是(填序号) 。
a.降温 b.加水稀释 c.加入NH4Cl d.加入NaHCO3
研究氨氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s) NaNO3(s)+ClNO(g) K1 ΔH1<0(Ⅰ)
NaNO3(s)+ClNO(g) K1 ΔH1<0(Ⅰ)
2NO(g)+Cl2(g) 2ClNO(g) K2 ΔH2<0(Ⅱ)
2ClNO(g) K2 ΔH2<0(Ⅱ)
(1)4NO2(g)+2NaCl(s) 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=__________(用K1、K2表示)。
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=__________(用K1、K2表示)。
(2)为研究不同条件对反应(Ⅱ)的影响,在恒温条件下,向2 L恒容密闭容器中加入0.2 mol NO和0.1 mol Cl2,10 min时反应(Ⅱ)达到平衡。测得10 min内v(ClNO)=7.5×10-3 mol·L-1·min-1,则平衡后n(Cl2)=________mol,NO的转化率α1=_______。其他条件保持不变,反应(Ⅱ)在恒压条件下进行,平衡时NO的转化率α2_____α1(填“>”“<”或“=”),平衡常数K2__________(填“增大”“减小”或“不变”)。若要使K2减小,可采取的措施是______________。
(3)实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH===NaNO3+NaNO2+H2O。含0.2 mol NaOH的水溶液与0.2 mol NO2恰好完全反应得1 L溶液A,溶液B为0.1 molL的CH3COONa溶液,则两溶液中c(NO3-)、c(NO2-)和c(CH3COO-)由大到小的顺序为_________________。(已知HNO2电离常数Ka=7.1×10-4 mol·L-1,CH3COOH的电离常数Ka=1.7×10-5 mol·L-1)
可使溶液A和溶液B的pH相等的方法是____________。
a.向溶液A中加适量水 b.向溶液A中加适量NaOH
c.向溶液B中加适量水 d.向溶液B中加适量NaOH
使用石油热裂解的副产物CH4来制取CO和H2,其生产流程如下图:

(1)工业上常利用反应Ⅰ产生的CO和H2合成可再生能源甲醇。
①已知CO(g)、CH3OH(l)的燃烧热分别为283.0 kJ·mol-1和726.5 kJ·mol-1,则CH3OH(l)不完全燃烧生成CO(g)和H2O(l)的热化学方程式为 。
(2)此流程的第I步反应为:CH4(g) + H2O(g)  CO(g) + 3H2(g),一定条件下CH4的平衡转化率与温度、压强的关系如图。则P1_________P2。(填“<”、“>”或“=”)100℃时,将1 mol CH4和2 mol H2O通入容积为10L的恒容密闭容器中,达到平衡时CH4的转化率为0.5。此时该反应的平衡常数K=____________。
CO(g) + 3H2(g),一定条件下CH4的平衡转化率与温度、压强的关系如图。则P1_________P2。(填“<”、“>”或“=”)100℃时,将1 mol CH4和2 mol H2O通入容积为10L的恒容密闭容器中,达到平衡时CH4的转化率为0.5。此时该反应的平衡常数K=____________。

(3)此流程的第II步反应CO(g) + H2O(g)  CO2(g) + H2(g),
CO2(g) + H2(g),
的平衡常数随温度的变化如下表:
| 温度/℃ |
400 |
500[ |
830 |
| 平衡常数K |
10 |
9 |
1 |
从上表可以推断:该反应是 反应(填“吸热”或“放热”),若在500℃时进行,设起始时CO和H2O的起始浓度均为0.020mol/L,在该条件下,反应达到平衡时,CO的转化率为 。
右图表示该反应在t1时刻达到平衡、在t2时刻因改变某个条件引起浓度变化的情况:图中t2时刻发生改变的条件是____(写出一种)。

(4)某化学兴趣小组构想将NO转化为HNO3(NO3-),装置如图,电极为多孔惰性材料。则负极的电极反应式是 。

恒温下,将a mol N2与b mol H2的混合气体通入一个固定容积的密闭容器中,发生如下反应:N2 (g) + 3 H2(g)  2NH3(g)
2NH3(g)
(1)若反应某时刻t时,n t (N2) =" 13" mol,n t (NH3) =" 6" mol,则a =__________mol;
(2)反应达平衡时,混合气体的体积为716.8 L(标况下),其中NH3的含量(体积分数)为25%,平衡时NH3的物质的量__________;
(3)原混合气体与平衡混合气体的总物质的量之比(写出最简整数比、下同),n(始)∶n(平) =__________;
(4)原混合气体中,a∶b =__________;
(5)达到平衡时,N2和H2的转化率之比,α(N2)∶α(H2)= __________;
(6)平衡混合气体中,n(N2)∶n(H2)∶n(NH3) =__________________。
在4L体积不变的密闭 容器中充入6molA气体和5molB气体,发生反应:
容器中充入6molA气体和5molB气体,发生反应:
3A (g) + B (g)  2C (g) + x D (g), 2分钟后反应达到平衡,生成了2molC,经测定D的浓度为0.25mol·L-1, 求:
2C (g) + x D (g), 2分钟后反应达到平衡,生成了2molC,经测定D的浓度为0.25mol·L-1, 求:
(1) x= 。
(2) 用B表示的2分钟内的平均反应速率______________________。
(3)达到平衡时 ,在相同温度下容器内混合气体的压强与反应前压强比为 。
,在相同温度下容器内混合气体的压强与反应前压强比为 。
(4)达到平衡状态时B的转化率为 。
已知在催化剂存在条件下,能发生如下反应:
CO + H2O(g)  H2 + CO2 + Q
H2 + CO2 + Q
(1)在5 L盛有固体催化剂(其体积可忽略不计)的密闭容器中,通入反应物,10 s后,生成了氢气0.2 g,则此10 s内CO的平均反应速率为v(CO) = ____ _0.002 mol/Ls______。
(2)在该密闭容器中,下列叙述可以说明反应已经达到平衡状态的是__ BC___
A.若容器体积不变,在一定温度下压强达到恒定
B.CO2的生成速率与H2O蒸气的生成速率之比为1 : 1
C.CO、H2O、H2、CO在容器中的物质的量浓度保持不变
D.反应体系中混合物的平均摩尔质量保持不变
(3)在上述反应达平衡状态后,分别改变条件,请完成下列两张图:
A.在第20 s时将容器体积缩小至 B.在第20 s时,向容器中注入少量的
原来的一半后压强变化图 CO气体后正逆反应速率变化图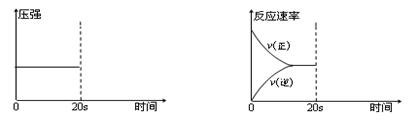
试题篮
()