已知2NO2(红棕色) N2O4(无色)可以同时相互转化,
N2O4(无色)可以同时相互转化,
①在密封有NO2的玻璃瓶中,升高温度,颜色加深,问NO2转化为N2O4是一个 热反应。
②在一个恒温恒压容器中,通入稀有气体。颜色 ,平衡 移动。
③在一个密闭恒容体系中,增大NO2的量,会引起NO2转化率 ,颜色 ,再通入稀有气体增大压强,平衡 移动,颜色 。
在一定温度下将3 mol CO2和2 mol H2混合于2 L的密闭容器中,发生如下反应:CO2(g)+H2(g)  CO(g)+H2O(g)。
CO(g)+H2O(g)。
(1)已知在700 ℃时,该反应的平衡常数K1=0.5,则该温度下反应CO(g)+H2O(g)  CO2(g)+H2(g) 的平衡常数K2=________。
CO2(g)+H2(g) 的平衡常数K2=________。
(2)已知在1 000 ℃时,该反应的平衡常数K3为1.0,则该反应为__ ______反应(填“吸热”或“放热”)。
(3)能判断该反应达到化学平衡状态的依据是_________。(填编号)
| A.容器中压强不变 |
| B.c(CO2)=c(CO) |
| C.生成a mol CO2的同时消耗a mol H2 |
| D.混合气体的平均相对分子质量不变 |
(4)在1 000 ℃下,某时刻CO2的物质的量为2.0 mol,则此时v正_______v逆(填“>”、“=”或“<”),该温度下反应达到平衡时,CO2的转化率为_________。
如图所示,两个连通容器用活塞分开,左右两室(体积相同)各充入一定量NO和O2,且恰好使两容器内气体密度相同。打开活塞,使NO与O2充分反应。(不考虑NO2与N2O4的转化)

(1)开始时左右两室分子数 (填“相同”或“不相同”)。
(2)反应前后NO室压强 (填“增大”或“减小”) 。
(3)最终容器内密度与原来 (填“相同”或“不相同”)。
(4)最终容器内 (填“有”或“无”)O2存在。
(共6分)下图是可逆反应A+2B  2C+3D的化学反应速率和化学平衡随外界条件改变而变化的情况。由图可推断:
2C+3D的化学反应速率和化学平衡随外界条件改变而变化的情况。由图可推断:

(1)正反应是 反应,(填放热或吸热)
(2)若A、B是气体,则C的状态是 ,D的状态是 。
(1)在一个固定体积为2升的密闭容器中,充入2molA和1molB,发生如下反应:2A(g)+B(g) 3C(g)+D(s),2分钟反应达到平衡,此时C的浓度为1.2 mol/L。
3C(g)+D(s),2分钟反应达到平衡,此时C的浓度为1.2 mol/L。
①2分钟内用B表示的平均反应速度为 ;
②若容器温度升高,平衡时混合气体的平均摩尔质量减小,则正反应为 (填“吸热”或“放热”)反应。
(2)一定温度下,在一定容积的密闭容器中发生如下可逆反应:
2A(g)+B(g) 2C(g)
2C(g)
在反应过程中,C的物质的量n(C)随时间的变化关系如下图所示(从t1时间开始对反应体系升高温度)。

试回答下列问题:
①A点时,反应的v(正)v(逆)(填“>”、“<”或“=”);
②此反应的逆反应为 热反应(填“放”或“吸”);
③A、B两点的正反应速率:v(A)v(B)(填“>”、“<” 或“=”)。
(11分)某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:
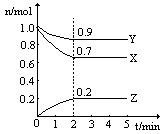
(1)该反应的化学方程式为 ;
(2)从开始至2min,Z的平均反应速率为 ;
(3)若X、Y、Z均为气体,反应达平衡时:
①此时体系的压强是开始时的 倍;
②若此时只将容器的体积扩大为原来的2倍,达新平衡时,容器内温度将降低(容器不与外界进行热交换),则该反应为 反应(填“放热”或“吸热”);达新平衡时,容器内混合气体的平均分子量比原平衡时 (填增大、减小或相等)。
(4)此反应达平衡后,若只加大体系压强,Z的物质的量减少,若Y是气体,则X的聚集状态是 。
下表是元素周期表的一部分,针对a~k十一种元素回答下列问题(请用具体化学式回答,否则不给分):
| 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
| 2 |
a |
c |
d |
|
e |
f |
g |
| 3 |
b |
h |
i |
|
|
j |
k |
(1)这些元素中非金属性最强的单质是 ,最高价氧化物对应水化物酸性最强的是 ,最高价氧化物对应水化物碱性最强的是 。
(2)表中k的氢化物的化学式为 ,它的还原性比j的氢化物还原性 (填“强”或“弱”),它水溶液的酸性比j的氢化物水溶液的酸性 (填“强”或“弱”)。
(3)e单质为 ,其结构式为 。
(4)用电子式表示h与k构成化合物的形成过程
(5)写出i的氧化物与强碱溶液反应的离子方程式
(6)H2和e的单质化合的反应是可逆反应,且该反应正方向放热。将等物质的量的H2、e的单质充入一恒容密闭容器中,在适当条件下反应。下列说法正确的是 (填写选项)。
A.升高温度,不论正反应方向还是逆反应方向速率都加快
B.向上述容器中充入适量Ar气可加快反应速率
C.反应过程中,e的单质的体积分数始终为50%
D.反应器内压强不随时间变化而变化,说明反应到达平衡
(6分)一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的量随时间变化的曲线如图所示:
(1)从反应开始到10 s,用Z表示的反应速率为________。X的物质的量浓度减少了___________,Y的转化率为________。
(2)该反应的化学方程式为_____________________。
(3)10 s后的某一时刻(t1)改变了外界条件,其速率随时间的变化图象如图所示:
则下列说法符合该图像的是________。
| A.t1时刻,增大了X的浓度 | B.t1时刻,升高了体系温度 |
| C.t1时刻,缩小了容器体积 | D.t1时刻,使用了催化剂 |
甲醇是重要的化工原料,又可称为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g) CH3OH(g) △H1
CH3OH(g) △H1
②CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H2
CH3OH(g)+H2O(g) △H2
③CO2(g)+H2(g) CO(g)+H2O(g) △H3
CO(g)+H2O(g) △H3
回答下列问题:
(1)已知△H1=-99kJ·mol-1 ,△H3=+41kJ·mol-1,则△H2= kJ·mol-1。
(2)反应①的化学平衡常数K的表达式为 ;图1中能正确反映平衡常数K随温度变化关系的曲线为 (填曲线标记字母),其判断理由是 。

(3)若开始各气体的物质的量一定时,体系中的CO平衡转化率(α)与温度和压强的关系如图2所示。则α(CO)值随温度升高而 (填“增大”或“减小”);图2中的压强由大到小为 ,其判断理由是 。
t℃时,将2molSO2和1molO2通入体积为2L的恒温恒容密闭容器中,发生如下反应:2SO2(g)+O2(g) 2SO3(g),△H=-Q,10分钟时反应达到化学平衡,此时测得反应物O2还乘余0.8mol,请填写下列空白
2SO3(g),△H=-Q,10分钟时反应达到化学平衡,此时测得反应物O2还乘余0.8mol,请填写下列空白
(1)从反应开始到达化学平衡,生成SO3的平均反应速为 ;平衡时SO2转化率为 。
(2)下列叙述能证明该反应已达到化学平衡状态的是 (填标号,下同)。
A.溶器内压强不再发生变化
B.SO2的体积分数不再发生变化
C.容器内气体原子总数不再发生变化
D.相同时间内消耗2nmolSO2的同时生成nmolO2
E.相同时间内消耗2nmolSO2的同时消耗nmolO2
(3)反应达到化学平衡后,以下操作将引起平衡向正反方向移动并能提高SO2转化率的是________。
A.向容器中通入少量O2
B.向容器中通入少量SO2
C.降低温度
D.使用催化剂
E.向容器中通入少量氦气(已知:氦气和SO2、O2、SO3都不发生反应)
(4)t2℃时,若将物质的量之比n(SO2):n(O2)=1:1的混合气体通入一个恒温恒压的密闭容器中,反应达到平衡时,混合气体体积减少了20%。SO2的转化率为________。
在2 L密闭容器内,800℃时反应2NO(g)+O2(g)=2NO2(g)体系中,n(NO)随时间的变化如下表:
| 时间(s) |
0 |
1 |
2 |
3 |
4 |
5 |
| n(NO)(mol) |
0.020 |
0.010 |
0.008 |
0.007 |
0.007 |
0.007 |
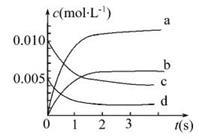
(1)上述反应在第5 s时,NO的转化率为 。
(2)如图中表示NO2变化曲线的是 。用O2表示0~2 s内该反应的平均速率v= 。
(3)能说明该反应已达到平衡状态的是 。
a.v(NO2)="2v" (O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
(4)铅蓄电池是常用的化学电源,其电极材料是Pb和PbO2,电解液为稀硫酸。工作时该电池总反应式为:PbO2 + Pb + 2H2SO4 = 2PbSO4 ↓ + 2H2O,据此判断工作时正极反应为______________。
(5)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当它们混合反应时,即产生大量无污染物质并放出大量热。反应的化学方程式为 。
(普通班做)在2L恒容密闭容器中,800℃时反应2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间的变化如下表:
2NO2(g)体系中,n(NO)随时间的变化如下表:
| 时间(s) |
0 |
1 |
2 |
3 |
4 |
5 |
| n(NO)(mol) |
0.020 |
0.010 |
0.008 |
0.007 |
0.007 |
0.007 |
(1)写出该反应的平衡常数表达式: ,已知K(300℃)>K(350℃),则该反应正反应为 反应(填“放热”或“吸热”),升高温度,正反应速率 ,(填“增大”“减小”或“不变”)。
(2)图中表示NO2的变化的曲线是______,用氧气表示0—2s内该反应平均反应速率v(O2)= 。
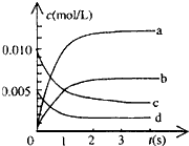
(3)求达平衡时NO的转化率为 。
(4)能说明该反应已经达到平衡状态的是 。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v(NO)逆=2v(O2)正 d.容器内的密度保持不变
(5)能够使该反应的反应速率增大,且平衡向正反应方向移动的是______。
a.及时分离出NO2气体 b.增大O2的浓度
c.适当升高温度 d.使用高效催化剂
(普通班做)(1)下图是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:____________________。


(2)氨是最重要的氮肥,是产量最大的化工产品之一。其合成原理为:
N2(g)+3H2(g) 2NH3(g) ΔH="-92.4" kJ·mol-1。在定容密闭容器中,使2 mol N2和6 mol H2混合发生反应,平衡时N2转化率为20%:
2NH3(g) ΔH="-92.4" kJ·mol-1。在定容密闭容器中,使2 mol N2和6 mol H2混合发生反应,平衡时N2转化率为20%:
①当反应达到平衡时,N2和H2的浓度比是 N2和H2的转化率比是 ,反应共放热 KJ。
②升高平衡体系的温度,混合气体的平均相对分子质量 ,密度 (填“变大”“变小”或“不变”)。
③当达到平衡时,充入氩气 ,平衡将 (填“正向”“逆向”或“不”)移动。
④若容器绝热,加热使容器内温度迅速升至原来的2倍,平衡将 (填“正向”“逆向”或“不”)移动。达到新平衡后,容器内温度 (填“大于”“小于”或“等于”)原来的2倍。
(实验班做)合成氨工业中氢气可由天然气和水蒸汽反应制备,其主要反应为:
CH4+ 2H2O CO2+4H2,已知:
CO2+4H2,已知:
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890KJ/mol
2H2(g)+O2(g)=2H2O(l) △H=-571.6KJ/mol
H2O(g)=H2O(l) △H=-44KJ/mol
(1)写出由天然气和水蒸汽反应制备H2的热化学方程式: 。
(2)某温度下,10L密闭容器中充入2mol CH4和3mol H2O(g),发生CH4(g)+ 2H2O(g)  CO2(g)+4H2(g)反应,过一段时间反应达平衡,平衡时容器的压强是起始时的1.4倍。
CO2(g)+4H2(g)反应,过一段时间反应达平衡,平衡时容器的压强是起始时的1.4倍。
则①平衡时,CH4的转化率为 ,H2的浓度为 ,反应共放出或吸收热量 KJ。
②升高平衡体系的温度,混合气体的平均相对分子质量 ,密度 。(填“变大”“变小”或“不变”)。
③当达到平衡时,充入氩气,并保持压强不变,平衡将 (填“正向”“逆向”或“不”)移动。
④若保持恒温,将容器压缩为5L(各物质仍均为气态),平衡将 (填“正向”“逆向”或“不”)移动。达到新平衡后,容器内H2浓度范围为 。
在生活中,需要对化学反应的速率和化学反应的限度进行研究,以便控制化学反应。
I.某实验小组以H2O2分解为例,研究浓度、催化剂、温度对反应速率的影响。按照如下方案完成实验。
| |
反应物 |
催化剂 |
温度 |
| ① |
10mL10% H2O2溶液 |
无 |
25℃ |
| ② |
10mL20% H2O2溶液 |
无 |
25℃ |
| ③ |
10mL20% H2O2溶液 |
无 |
40℃ |
| ④ |
10mL20% H2O2溶液 |
1~2滴0.1mol/LFeCl3溶液 |
40℃ |
通过实验得到氧气的体积与时间的关系如右图所示,
回答下列问题:

(1)代表实验①的图示是 。
(2)对比实验③和④的目的是 。
(3)通过上面对比实验,所得的实验结论是 。
Ⅱ.一定温度下,在体积为2L的恒容密闭容器中充入1molN2和3 mol H2,一定条件下发生反应:N2(g)+3H2(g) 2NH3(g),测得其中N2物质的
2NH3(g),测得其中N2物质的 量随时间变化如图所示。回答下列问题:
量随时间变化如图所示。回答下列问题:

(4)从开始反应到t2时刻,氨气的平均反应速率为 。
(5)在t3时刻,氢气的转化率为 。
试题篮
()