25 ℃时,合成氨反应的热化学方程式为:
N2(g)+3H2(g)⇌2NH3(g) △H=-92.4 kJ/mol
(1)在该温度时,取l mol N2和3 mol H2放在密闭容器中,在催化剂存在下进行反应,测得反应放出的热量总是小于92.4 kJ。其原因是 。
(2)为了提高NH3的产率,应如何选择反应条件?
已知反应A(g)+3B(g)⇌2C(g)在一定温度下达到平衡,该反应的平衡常数表达式为 。
若各物质的平衡浓度分别为c(A)="2.0" mol/L、c(B)="2.0" mol/L、c(C)="1.0" mol/L,则K= 。
在一定条件下xA+yB zC达到平衡时,请填写:
zC达到平衡时,请填写:
(1)若A、B、C都是气体,在减压后平衡向逆反应方向移动,则x、y、z关系是___________________。
(2)已知B、C是气体,现增加A的物质的量,平衡不移动,说明A是_________________(填状态)。
(3)若容器容积不变,加入气体B,气体A的转化率__________(填“增大”“减小”或“不变”)。
(4)若加热后,C的百分含量减小,则正反应是___________反应(填“放热”或“吸热”)。
(5)若容器容积不变,且A、B、C都是气体,向容器中充入稀有气体,则 。
A.化学平衡向正反应方向移动 B.化学平衡向逆反应方向移动
C.化学平衡不移动 D.反应停止
乙苯催化脱氢制苯乙烯反应:

(1)已知:
| 化学键 |
C-H |
C-C |
C=C |
H-H |
| 键能/kJ·molˉ1 |
412 |
348 |
612 |
436 |
计算上述反应的△H=____________ kJ·mol-1。
(2)维持体系总压强p恒定,在温度T时,物质的量为n、体积为V的乙苯蒸汽发生催化脱氢反应。已知乙苯的平衡转化率为α,则在该温度下反应的平衡常数K=____________ (用α等符号表示)。
(3)工业上,通常在乙苯蒸气中掺混水蒸气(原料气中乙苯和 水蒸气的物质的量之比为1︰9),控制反应温度600℃,并保持体系总压为常压的条件下进行反应。在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了H2以外的产物中苯乙烯的物质的量分数)示意图如下:

①掺入水蒸气能提高乙苯的平衡转化率,解释说明该事实______________。
②控制反应温度为600℃的理由是 ____________。
(4)某研究机构用CO2代替水蒸气开发了绿色化学合成工艺——乙苯-二氧化碳耦合催化脱氢制苯乙烯。保持常压和原料气比例不变,与掺水蒸汽工艺相比,在相同的生产效率下,可降低操作温度;该工艺中还能够发生反应:CO2+H2=CO+H2O,CO2+C=2CO。新工艺的特点有__________(填编号)。
① CO2与H2反应,使乙苯脱氢反应的化学平 衡右移
② 不用高温水蒸气,可降低能量消耗
③ 有利于减少积炭
④ 有利于CO2资源利用
甲醇被称为2l世纪的新型燃料。参考下列图表和有关要求回答问题:
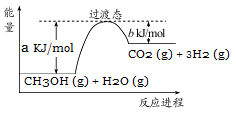
(1)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的一种原理是CH3OH(g)和H2O(g)反应生成CO2和H2。上图是该过程中能量变化示意图,请写反应进程CH3OH(g)和H2O(g)反应的热化学方程式 。
(2)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的另一种反应原理是:
CH3OH(g)+1/2O2(g) = CO2(g)+2H2(g) △H="c" kJ/mol
又知H2O(g) = H2O(l) △H="d" kJ/mol。
则甲醇燃烧生成液态水的热化学方程式为 。
(3)以CH3OH燃料电池为电源电解法制取ClO2。二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。
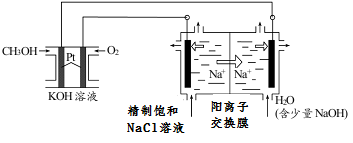
① CH3OH燃料电池放电过程中,通入O2的电极附近溶液的pH___________(填“增大”、“减小”、“不变”)。
② 图中电解池用石墨作电极,在一定条件下电解饱和食盐水制取 ClO2。阳极产生 ClO2的反应式为 。电解一段时间,从阴极处收集到的气体比阳极处收集到气体多 6.72L时(标准状况,忽略生成的气体溶解),停止电解,通过阳离子交换膜的阳离子为______________mol。
③用平衡移动原理解释图中电解池中阴极区pH增大的原因:
化学反应原理在科研和生产中有广泛应用
(1)利用“化学蒸气转移法”制备TaS2晶体,发生如下反应TaS2(s)+2I2(g) TaI4(g)+S2(g)△H﹥0 (I)反应(I)的平衡常数表达式K= ,若K=1,向某恒容密闭容器中加入1mol I2(g)和足量TaS2(s),I2(g)的平衡转化率为 。
TaI4(g)+S2(g)△H﹥0 (I)反应(I)的平衡常数表达式K= ,若K=1,向某恒容密闭容器中加入1mol I2(g)和足量TaS2(s),I2(g)的平衡转化率为 。

(2)如图所示,反应(I)在石英真空管中进行,先在温度为T2的一端放入未提纯的TaS2粉末和少量I2(g),一段时间后,在温度为T1的一端得到了纯净的TaS2晶体,则温度T1 T2(填“﹥”“﹤”或“=”)。上述反应体系中循环使用的物质是 。
(3)利用I2的氧化性可测定钢铁中硫的含量。做法是将钢铁中的硫转化为H2SO3,然后用一定浓度的I2溶液进行滴定,所用指示剂为 ,滴定反应的离子方程式为 。
(4)25℃时,H2SO3 HSO3-+H+的电离常数Ka=1×10-2mol/L,则该温度下NaHSO3的水解平衡常数Kh= mol/L,若向NaHSO3溶液中加入少量的I2,则溶液中
HSO3-+H+的电离常数Ka=1×10-2mol/L,则该温度下NaHSO3的水解平衡常数Kh= mol/L,若向NaHSO3溶液中加入少量的I2,则溶液中 将 (填“增大”“减小”或“不变”)。
将 (填“增大”“减小”或“不变”)。
工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大损害,必须进行处理.常用的处理方法有两种.方法1:还原沉淀法.该法的工艺流程为
其中第①步存在平衡:2CrO42-(黄色)+2H+ Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O
(1)若平衡体系的pH=2,该溶液显____________色.
(2)能说明第①步反应达平衡状态的是________________
a.2v正(Cr2O72-)=v逆(CrO42-)
b.Cr2O72-和CrO42-的浓度相同
c.溶液的颜色不变
(3)第②步中,还原1mol Cr2O72-离子,需要_________mol的FeSO4•7H2O,
(4)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)⇌Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)•c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至____________
方法2:电解法.
该法用Fe做电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀.
(5)用Fe做电极的原因为__________
(6)在阴极附近溶液pH升高的原因是(用电极反应解释)____________,溶液中同时生成的沉淀还有_________。
有X、Z、W三种含14个电子的粒子,其结构特点如下:
| 粒子代码 |
X |
Z |
W |
| 原子核数目 |
单核 |
同元素构成的两核 |
同元素构成的两核 |
| 粒子的电性 |
电中性 |
两个负电荷 |
电中性 |
(1)X的氧化物晶体中含有化学键类型是_____________。
(2)Z与钙离子组成的化合物的电子式为_____________。
(3)组成W的元素的简单氢化物极易溶于水的主要原因是 ,该氢化物与空气可以构成一种燃料电池,产物为无毒物质,电解质溶液是KOH溶液,其负极的电极反应式为____ 。在常温下,用该电池电解1.5 L 1mol/LNaCl溶液,当消耗标准状况下1.12LW的简单氯化物时,NaCl溶液的pH=
(假设电解过程中溶液的体积不变)。
(4)M原子核外比X原子多2个电子。可逆反应2MO2(气)+O2(气) 2MO3(气)在两个密闭容器中进行,A容器中有一个可上下移动的活塞,B容器可保持恒容(如图所示),若在A、B中分别充入1molO2和2mol MO2,使气体体积V(A)=V(B),在相同温度下反应。则:达平衡所需时间:t(A)___________t (B)(填“>”、“<”、“=”,或“无法确定”,下同)。平衡时MO2的转化率:a(A)_____________a(B)。
2MO3(气)在两个密闭容器中进行,A容器中有一个可上下移动的活塞,B容器可保持恒容(如图所示),若在A、B中分别充入1molO2和2mol MO2,使气体体积V(A)=V(B),在相同温度下反应。则:达平衡所需时间:t(A)___________t (B)(填“>”、“<”、“=”,或“无法确定”,下同)。平衡时MO2的转化率:a(A)_____________a(B)。
(5)欲比较X和M两元素的非金属性相对强弱,可采取的措施有 (填序号)。

a.比较这两种元素的气态氢化物的沸点
b.比较这两种元素的单质在常温下的状态
c.比较这两种元素的气态氢化物的稳定性
d.比较这两种元素的单质与氢气化合的难易
高炉炼铁过程中发生的主要反应为:
 Fe2O3(s)+CO(g)
Fe2O3(s)+CO(g)
 Fe(s)+CO2(g)
Fe(s)+CO2(g)
已知该反应在不同温度下的平衡常数如下表:请回答下列问题:
| 温度/℃ |
1000 |
1150 |
1300 |
| 平衡常数 |
4.0 |
3.7 |
3.5 |
(1)该反应的平衡常数表达式K=________,ΔH________0 ( 填“>”.“<”或“=” );
(2)在体积为10 L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0 mol,反应经过10 min后达到平衡。该时间范围内反应的平均反应速率v(CO2)= ,CO的平衡转化率为 。
(3)欲提高(2)中CO的平衡转化率,可采取的措施是________。
A 减少Fe的量 B 增加Fe2O3的量 C 移出部分CO2
D 提高反应温度 E 减小容器的容积 F 加入合适的催化剂
可逆反应:aA(g)+ bB(g) cC(g)+ dD(g);根据图回答:
cC(g)+ dD(g);根据图回答:

(1)压强 P1比P2 (填大或小);(2)(a +b)比(c +d) (填大或小);
(3)温度t1℃比t2℃ (填高或低);(4)正反应为 反应。
在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
| t℃ |
700 |
800 |
830 |
1000 |
1200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K = 。
(2)该反应为 反应(填“吸热”或“放热”)。
(3)能判断该反应是否达到化学平衡状态的依据是 (多选扣分)。
A.容器中压强不变 B.混合气体中 c(CO)不变
C.υ正(H2)=υ逆(H2O) D.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为 ℃。
(5)某温度下,将CO和水蒸气各1mol置于体积为1L的密闭容器中反应,达到平衡后测得CO2为0.5mol,再通入4mol水蒸气,达到新的平衡后CO2的物质的量等于__________mol。
减少污染、保护环境是全世界最热门的课题。请回答下列问题:
(1)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。已知:H2(g)+1/2O2(g)=H2O(g)  H= -241.8KJ/mol
H= -241.8KJ/mol
C(s)+1/2O2(g)=CO(g)  H= -110.5KJ/mol
H= -110.5KJ/mol
写出焦炭与水蒸气反应的热化学方程式 ;
②洗涤含SO2的烟气,以下物质可作洗涤剂的是 ;
a.Ca(OH)2 b.Na2CO3 c.CaCl2 d.NaHSO3、
(2)污染物CO在催化剂作用下可以与H2反应生成甲醇:CO(g)+2H2(g) CH3OH(g)。
CH3OH(g)。
①在恒容体系中,可以判断反应达到平衡状态的依据是 (填序号).
a. v正(CH3OH)= v逆(CO) b.混合气体的密度不变
c. 混合气体的平均相对分子质量不变 d. c(CO):c(H2): c( CH3OH)= 1:2:1
②在密闭容器中充有10molCO与20molH2,CO的平衡转化率与温度、压强的关系如下图

M、N、Q三点的平衡常数KM、KN、KQ的大小关系为____ __。
(3)汽车尾气中NOx和CO的生成及转化为:
①已知气缸中生成NO的反应为:N2(g)+O2(g)  2NO(g)
2NO(g)  H>0
H>0
汽车启动后,气缸温度越高,单位时间内NO排放量越大,原因是 。
②若加入1mol空气(含有0.8molN2和0.2molO2),1300℃时在密闭容器内反应达到平衡,测得NO为8×10-4mol。计算该温度下的平衡常数K(写出计算过程,计算过程中数据可作近似处理)
③汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO:
2CO(g)=2C(s)+O2(g)  H>0,该设想能否实现? (选填“能”或“不能”),依据是 。
H>0,该设想能否实现? (选填“能”或“不能”),依据是 。
④ 目前,在汽车尾气系统中装置催化转化器可减少CO和NO的污染,其化学反应方程式为 。
硫酸铅(PbSO4)广泛应用于制造铅蓄电池、白色颜料等。利用方铅矿精矿(PbS)直接制备硫酸铅粉末的流程如下:

已知:(ⅰ)PbCl2(s)+2Cl-(aq) PbCl42-(aq) △H>0
PbCl42-(aq) △H>0
(ⅱ)Ksp(PbSO4)=1.08×10-8, Ksp(PbCl2)=1.6×10-5
(ⅲ)Fe3+、Pb2+以氢氧化物形式完全沉淀时,溶液的PH值分别为3.2、7.04
(1)步骤Ⅰ中生成PbCl2和S的离子方程式 ,加入盐酸的另一个目的是为了控制PH值在0.5~1.0,原因是 。
(2)用化学平衡移动的原理解释步骤Ⅱ中使用冰水浴的原因 。
(3)写出PbCl2晶体转化为PbSO4沉淀的离子方程式 。
(4)请用离子方程式解释加入H2O2后滤液2可循环利用的原因 ,滤液3是 。
(5)铅蓄电池的电解液是硫酸,充电后两个电极上沉积的PbSO4分别转化为PbO2和Pb,充电时阴极的电极反应式为 。
碳及其化合物有广泛的用途。
(1)反应C(s)+ H2O(g) CO(g)+H2(g) ΔH=" +131.3" kJ•mol-1,达到平衡后,体积不变时,以下有利于提高H2产率的措施是 。
CO(g)+H2(g) ΔH=" +131.3" kJ•mol-1,达到平衡后,体积不变时,以下有利于提高H2产率的措施是 。
| A.增加碳的用量 | B.升高温度 | C.用CO吸收剂除去CO | D.加入催化剂 |
(2)已知,C(s)+CO2(g) 2CO(g)△H=" +172.5" kJ•mol-1
2CO(g)△H=" +172.5" kJ•mol-1
则反应CO(g)+H2O(g) CO2(g)+H2(g) △H= ____________________。
CO2(g)+H2(g) △H= ____________________。
(3)CO与H2一定条件下反应生成甲醇(CH3OH),可利用甲醇设计一个燃料电池,用KOH溶液作电解质溶液,多孔石墨做电极,该电池负极反应式为______________________________。
(4)在一定温度下,将CO(g)和H2O(g)各0.16 mol分别通入到体积为2.0 L的恒容密闭容器中,发生以下反应:CO(g)+H2O(g)  CO2(g)+H2(g),得到如下数据:
CO2(g)+H2(g),得到如下数据:
| t / min |
2 |
4 |
7 |
9 |
| n(H2O)/mol |
0.12 |
0.11 |
0.10 |
0.10 |
1其它条件不变,降低温度,达到新平衡前 v(逆) _____ v(正) (填“>”、“<”或“=”) 。
2该温度下,此反应的平衡常数K=____________________________;
3其它条件不变,再充入0.1mol CO和0.1mol H2O(g),平衡时CO的体积分数______(填“增大”、“减小”或“不变”)。
试题篮
()