在100℃时,将0.200 mol的四氧化二氮气体充入2L抽空的密闭容器中,每隔一定时间对该容器内的物质进行分析,得到如下表格:
| 时间 |
0 |
20 |
40 |
60 |
80 |
100 |
| c(N2O4) |
0.100 |
c1 |
0.050 |
c3 |
a |
b |
| c(NO2) |
0.000 |
0.060 |
c2 |
0.120 |
0.120 |
0.120 |
试填空:
(1)该反应的化学方程式为_________________,达到平衡时四氧化二氮的转化率为________%。
(2)20s时四氧化二氮的浓度c1=________mol·L-1,在0~20s时间段内,四氧化二氮的平均反应速率为________mol•L-1•s-1。
(3)若在相同情况下最初向容器中充入的是二氧化氮气体,要达到上述同样的平衡状态,二氧化氮的初始浓度为________mol•L-1。
汽车尾气净化的一个反应为:2NO(g)+2CO(g)⇌N2(g)+2CO2(g)。某小组同学为探究转化效果,在一定温度下,向2 L容器中充入NO(g)和CO(g)各2.0 mol,使其发生反应,测得达到平衡后容器的压强是起始压强的4/5。求:
(1)NO的转化率 ;
(2)此温度下的平衡常数 。
向某密闭容器中加入0.30mol A、0.10mol C和一定量的B三种气体,一定条件下发生反应,各物质浓度随时间变化如图1所示.如图2为t2时刻后改变容器中条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各只改变一种条件,所改变的条件均不同.已知t3~t4阶段为使用催化剂.

图1 图2
(1)若t1=20s,则t0~t1阶段以C浓度变化表示的反应速率为v(C)= ; t4~t5阶段改变的条件为 ;(t0为坐标原点)
(2)若t2~t3阶段,C的体积分数在不断地变小,则此阶段v(正) v(逆) (填“>”、“=”、“<”); t3~t4的平衡常数K= 。
(3)t5~t6阶段改变的条件为 ;B的起始物质的量为 ;
(4)t1达到平衡后,若保持容器温度和体积不变,再向容器中加入0.08mol A,0.2mol C,则平衡 (填“向正反应方向”、“向逆反应方向”或“不”)移动.
(5)在温度和容积不变条件下,能判断该反应达到平衡的依据是
A.混合气体的平均相对分子质量不变 B.反应体系的总压强不变
C.生成2mol C的同时生成3mol A D.2v生成(A)=3v生成(C)
一定温度下,在容积固定的V L密闭容器中加入n mol A、2n mol B,发生反应:A(g)+2B(g) 2C(g) ΔH>0,反应达平衡后测得平衡常数为K,此时A的转化率为X。
2C(g) ΔH>0,反应达平衡后测得平衡常数为K,此时A的转化率为X。
(1)一段时间后上述反应达到平衡。则下列说法中不正确的是________(填字母)。
A.物质A、B的转化率之比为1∶1
B.起始时刻和达到平衡后容器中的压强之比为3∶(3-x)
C.充入惰性气体(如Ar),平衡向正反应方向移动
D.当2v正(A)=v逆(B)时,反应一定达到平衡状态
(2)K和x的关系满足K=____________。
(3)该反应的逆反应速率与时间的关系
如图所示。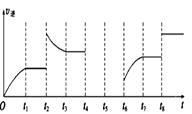
①由图可知,反应在t1、t3、t7时都达到了平衡,而t2、t8时都改变了一种条件,试判断改变的条件:
t2时_________________________; t8时_________________________。
②t2时平衡向__________(填“正反应”或“逆反应”)方向移动。
③若t4时降压,t5时达到平衡,t6时增大反应物的浓度,请在图中画出t4~t6时逆反应速率与时间的关系线。
25 ℃,101 k Pa时,已知下列可逆反应的焓变和化学平衡常数分别为:
①(g)+2B(g) 2C(g)+2D(l) ΔH1=-250.kJ·mol-1 K1=0.2
2C(g)+2D(l) ΔH1=-250.kJ·mol-1 K1=0.2
②(s)+B(g) C(g) ΔH2=-310 kJ·mol-1 K2=2
C(g) ΔH2=-310 kJ·mol-1 K2=2
③(g)+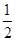 B(g)
B(g) D(l) ΔH3=-200 kJ·mol-1 K3=0.8
D(l) ΔH3=-200 kJ·mol-1 K3=0.8
(1)则反应2E(s)+2F(g)+B(g) A(g)的ΔH= ,K= 。
A(g)的ΔH= ,K= 。
(2)写出反应①的平衡常数表达式: 。
(3)反应②的逆反应的平衡常数K4= 。
(4)对反应①而言,升高温度平衡常数 ,增大压强平衡常数 。(填“增大或降低或不变”)
在一定体积的密闭容器中进行化学反应:CO2 (g)+H2(g)  CO(g) + H2O(g),其化学平衡常数K和温度的关系如下表所示:
CO(g) + H2O(g),其化学平衡常数K和温度的关系如下表所示:
| t/ |
700 |
800 |
830 |
1000 |
1200 |
| K |
0.6 |
0. 9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=______________。
(2)该反应为___________反应(填“吸热”或“放热”)。
(3)某温度下,平衡浓度符合下式:c (CO2)·c (H2) =" c" (CO) ·c (H2O),试判断此时的温度为_______
(4)能判断该反应是否达到化学平衡状态的依据是( )
A.容器中物质的量不变
B.混合气体中各物质的浓度不变
C.消耗nmolCO2的同时,生成了2nmolH2
D.c (CO2) =" c" (H2O)
将一定量的SO2和含0.7mol氧气的空气(忽略CO2)放入一定体积的密闭容器中,550℃时,在催化剂作用下发生反应:2SO2+O2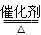 2SO3 ΔH <0。反应达到平衡后,将容器中的混合气体通过过量NaOH溶液,气体体积减少了21.28L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6L(以上气体体积均为标准状况下的体积)。请回答下列问题:
2SO3 ΔH <0。反应达到平衡后,将容器中的混合气体通过过量NaOH溶液,气体体积减少了21.28L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6L(以上气体体积均为标准状况下的体积)。请回答下列问题:
(1)判断该反应达到平衡状态的标志是 。(填字母)
a.SO2和SO3浓度相等 b.SO2百分含量保持不变
c.容器中气体的压强不变 d.SO3的生成速率与SO2的消耗速率相等
e.容器中混合气体的密度保持不变
(2)欲提高SO2的转化率,下列措施可行的是 。(填字母)
a.向装置中再充入N2 b.向装置中再充入O2
c.改用效率更高的催化剂 d.升高温度
(3)求该反应达到平衡时SO2的转化率(用百分数表示)为____________。
(4)若将平衡混合气体的5%通入过量的BaCl2溶液,生成沉淀___________克?
乙苯催化脱氢制苯乙烯反应:
(1)已知:
| 化学键 |
C-H |
C-C |
C=C |
H-H |
| 键能/kJ·molˉ1 |
412 |
348 |
612[ |
436 |
计算上述反应的△H=____________ kJ·mol-1。
(2)维持体系总压强p恒定,在温度T时,物质的量为n、体积为V的乙苯蒸汽发生催化脱氢反应。已知乙苯的平衡转化率为α,则在该温度下反应的平衡常数K=____________(用含α等字母的代数式表示)。
在密闭容器中,使3 mol N2和6 mol H2混合发生下列反应:N2(g)+3H2(g)  2NH3(g) ΔH<0。已知平衡时NH3为nmol。回答下列问题:
2NH3(g) ΔH<0。已知平衡时NH3为nmol。回答下列问题:
(1)上述平衡中,N2和NH3的浓度比= (用含n的代数式表示);N2和H2的转化率之比=________。
(2)升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量________,密度___________ (填“变大”、“变小”或“不变”) 。
(3)当达到平衡时,充入氩气,并保持压强不变,平衡将________(填“正向”、“逆向”或“不”)移动。
(4)若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,达到新平衡后,容器内温度________(填“>”、“<”或“=”)原来的2倍。
I2可溶于KI溶液并存在下列平衡:I2(aq)+I-(aq) I3-(aq)。测得不同温度下该反应的平衡常数如右表。回答下列问题:
I3-(aq)。测得不同温度下该反应的平衡常数如右表。回答下列问题:
| t/℃ |
5 |
15 |
25 |
35 |
50 |
| K |
1100 |
841 |
680 |
533 |
409 |
(1)上述反应的ΔH 0(填“>”、“<”或“=”);
(2)上述平衡体系中加入苯,平衡向 方向移动(填“正反应”或“逆反应”);
(3)温度一定,向上述平衡体系中加入少量KI固体,平衡常数 (填“增大”或“减少”或“不变”)。
在水溶液中橙色的Cr2O72-与黄色的CrO42-存在如下平衡:Cr2O72-+H2O 2CrO42-+2H+,已知重铬酸钾(K2Cr2O7)稀溶液为橙色。取甲、乙两支试管分别加入2mL重铬酸钾稀溶液,进行如下操作:
2CrO42-+2H+,已知重铬酸钾(K2Cr2O7)稀溶液为橙色。取甲、乙两支试管分别加入2mL重铬酸钾稀溶液,进行如下操作:
(1)向甲试管中加入NaOH溶液,上述平衡向方向 移动(填“正反应”或“逆反应”);
(2)向乙试管中加入足量Ba(NO3)2溶液(已知BaCrO4为黄色沉淀),溶液最终显 色。
化工行业的发展必须符合国家节能减排的总体要求。请回答下列问题:
(1)已知C(s)+H2O(g) CO(g)+H2(g),则该反应的平衡常数表达式为 。
CO(g)+H2(g),则该反应的平衡常数表达式为 。
(2)已知在一定温度下,
C(s)+CO2(g)  2CO(g) △H1
2CO(g) △H1
CO(g)+H2O(g)  H2(g)+CO2(g) △H2
H2(g)+CO2(g) △H2
C(s)+H2O(g)  CO(g)+H2(g) △H3
CO(g)+H2(g) △H3
则△H1、△H2、△H3之间的关系是: 。
(3)通过研究不同温度下平衡常数可以解决某些实际问题。已知等体积的一氧化碳和水蒸气进入反应时,会发生如下反应: CO(g)+H2O(g)  H2(g)+CO2(g),该反应平衡常数随温度的变化如右表所示。
H2(g)+CO2(g),该反应平衡常数随温度的变化如右表所示。
| 温度/℃ |
400 |
500 |
800 |
| 平衡常数K |
9.94 |
9 |
1 |
则该反应的正反应方向是 _反应(填“吸热”或“放热”),在500℃时,若设起始时CO和H2O的起始浓度均为0.020mol/L,则CO的平衡转化率为 。
(4)从氨催化氧化可以制硝酸,此过程中涉及氮氧化物,如NO、NO2、N2O4等。对反应N2O4(g)  2NO2(g) △H>0在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如右图所示。下列说法正确的是 :
2NO2(g) △H>0在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如右图所示。下列说法正确的是 :

A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.B、C两点的气体的平均相对分子质量:B<C
D.由状态A到状态B,可以用加热的方法
E.A、C两点的化学平衡常数:A=C
(5)工业上用Na2SO3吸收尾气中的SO2,再用如图装置电解(惰性电极)NaHSO3制取H2SO4(阴离子交换膜只允许阴离子通过),阳极电极反应式为: .

一定条件下,在体积为3 L的密闭容器中反应:CO(g)+ 2H2(g) CH3OH(g)达到化学平衡状态。
CH3OH(g)达到化学平衡状态。

(1)根据右图,升高温度,K值将 (填“增大”、“减小”或“不变”)。
(2)500℃时,从反应开始到达到化学平衡,以H2的浓度变化表示的化学反应速率是 (用nB、tB表示)。
(3)该可逆反应达到化学平衡状态的标志是 (填字母)。
a、CO、H2、CH3OH的浓度均不再变化
b、混合气体的密度不再改变
c、混合气体的平均相对分子质量不再改变
d、v生成(CH3OH)= v消耗(CO)
(4)300℃时,将容器的容积压缩到原来的1/2,在其他条件不变的情况下,对平衡体系产生的影响是 (填字母)。
a、c(H2)减少 b、正反应速率加快,逆反应速率减慢
c、CH3OH 的物质的量增加 d、重新平衡时c(H2)/ c(CH3OH)减小
(5)根据题目有关信息,请在右下坐标图中标示出该化学反应过程的能量变化(标明信息)。

(6)以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。已知该燃料电池的总反应式为:2CH3OH +3O2+4OH- = 2CO32- + 6H2O,该电池中负极上的电极反应式是:
2CH3OH–12e-+16OH-= 2CO32-+ 12H2O ,则正极上发生的电极反应为: 。
运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义
(1)硫酸生产中,SO2催化氧化生成SO3; 2SO2(g)+O2(g) 2SO3(g),平衡时,混合体系中SO3的百分含量和温度的关系如下图所示。根据图示回答下列问题:
2SO3(g),平衡时,混合体系中SO3的百分含量和温度的关系如下图所示。根据图示回答下列问题:

①2SO2(g)+O2(g) 2SO3(g)的△H 0(填“>”或“<”):若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡 移动(填“向左”“向右”或“不移动”)。
2SO3(g)的△H 0(填“>”或“<”):若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡 移动(填“向左”“向右”或“不移动”)。
②若温度为T1、T2,反应的平衡常数分别为K1,K2,则K1 K2;温度为T1时,反应进行到状态D时,
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
(2)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用:

①如右图是一定的温度和压强下N2(g)和H2(g)反应生成lmol NH3(g)过程中能量变化示意图,图中E1、E2分别表示的意义是 、 。
②请写出工业合成氨的热化学方程式: (△H的数值用含字母Q1、Q2的代数式表示)
(3)SF6是一种优良的绝缘气体,分子结构中只存在S—F键。已知:1 mol S(s)转化为气态硫原子吸收能量280 kJ,断裂1 mol F—F、S—F键需吸收的能量分别为160 kJ、330 kJ。则S(s)+3F2(g)===SF6(g)的反应热ΔH为__________________。
已知N2(g)+3H2(g)⇌2NH3(g);△H=﹣Q1 kJ·mol-1(Q1>0),在一个有催化剂的固定容积的容器中加入1molN2和3molH2,在500℃时充分反应,达平衡后NH3的浓度为w mol•L﹣1,放出热量为Q2 kJ.
(1)达到平衡时,N2的转化率为 ;若此时向原容器中通入少量的氩气,N2的转化率将 (填“增大”、“减小”或“不变”)
(2)若在原来的容器中,只加入2mol NH3,500℃时充分反应达平衡后,吸收热量Q3 kJ,则NH3浓度 (填>、=、<)w mol•L﹣1,Q1、Q2、Q3之间满足何种关系 。
(3)下列措施可以同时提高反应速率和H2的转化率是(填选项序号) .
a.选择适当的催化剂 b.增大压强 c.及时分离生成的NH3 d.升高温度
(4)若将上述容器改为恒压容器(反应前体积相同),起始时加入1molN2和3 molH2,500℃时充分反应达平衡后,放出热量Q4kJ,则Q2 Q4(填“>”、“<”或“=”).
试题篮
()