恒温下,a mol N2与b mol H2的混合气体通入一个固定容积的密闭容器中,发生反应:N2(g)+3H2(g) 2NH3(g)
2NH3(g)
(1)若反应进行到某时刻t时,n(N2)="13" mol,n(NH3)=" 6" mol,a= 。
(2)反应达到平衡时,混合气体的体积为716.8 L(标准状况下),其中NH3的含量(体积分数)为25%。计算平衡时NH3的物质的量是 。
(3)原混合气体与平衡混合气体的总物质的量之比(写出最简整数比,下同),n(始)∶n(平)=_________。
(4)原混合气体中,a∶b=_________。
(5)平衡混合气体中,n(N2)∶n(H2)∶n(NH3) =
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池。已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ·mol-1、-283.0kJ·mol-1和-726.5kJ·mol-1。请回答下列问题:
(1)用太阳能分解10 mol水消耗的能量是_____________kJ;
(2)甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为 ;
(3)在容积为2L的密闭容器中,由CO2和H2合成甲醇,在其他条件不变得情况下,考察温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300℃);
下列说法正确的是______(填序 号)
号)
①温度为T1时,从反应开始到平衡,生成甲醇的平均速率为 v(CH3OH)=  mol·L-1·min-1
mol·L-1·min-1
②该反应在T1时的平衡常数比T2时的小
③该反应为放热反应
④处于A点的反应体系从T1变到T2,达到平衡时 增大
增大
(4)在T1温度时,将1molCO2和3molH2充入一密闭恒容器中,充分反应达到平衡后,若CO2转化率为a,则容器内的压强与起始压强之比为 ;
(5)在直接以甲醇为燃料电池中,电解质溶液为酸性,负极的反应式为 、正极的反应式为 。
已知2A(g)+B(g) 2C(g),向容积为1L的密闭容器中加入0.050 mol A和0.025mol B,在500℃时充分反应,达平衡后测得c(C)="0.040" mol·L-1,放出热量Q1kJ。
2C(g),向容积为1L的密闭容器中加入0.050 mol A和0.025mol B,在500℃时充分反应,达平衡后测得c(C)="0.040" mol·L-1,放出热量Q1kJ。
(1)能说明上述反应已经达到化学平衡状态的是 (填写序号);
a.v(C)="2v(B) "
b.容器内压强保持不变
c.v逆(A)=2v正(B)
d.容器内气体的密度保持不变
(2)若在相同的容器中只加入0.050 mol C,500℃时充分反应达平衡后,吸收热量Q2kJ,则Q1与Q2之间的关系式可表示为 (用含Q1、Q2的代数式表示);
(3)500℃时,上述反应的化学平衡常数K= ;
(4)已知:K(300℃)>K(350℃),该反应是 (填“放”或“吸”)热反应;若反应温度升高,A的转化率 (填“增大”、“减小”或“不变”);
(5)某温度下,A的平衡转化率(a)与体系总压强(P)的关系如图所示,平衡状态由a变到b时,化学平衡常数K(A) K(B)(填“>”、“<”或“=”)。
随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视。
⑴目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1 L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49.0kJ/mol
CH3OH(g)+H2O(g) △H=-49.0kJ/mol
测得CO2和CH3OH(g)的浓度随时间变化如图所示。
①从反应开始到平衡,氢气的平均反应速率v(H2)=___________mol/(L·min)。
②该反应的平衡常数表达式为__________________。
③下列措施中能使n(CH3OH)/n(CO2)增大的是___________。
A.升高温度 |
B.充入He(g),使体系压强增大 |
| C.将H2O(g)从体系中分离 | D.再充入1mol CO2和3mol H2 |
⑵有人提出,可以设计反应2CO=2C+O2来消除CO的污染。请你判断是否可行并说出理由:______________________________________________。
在450℃并有催化剂存在下,于一容积恒定的密闭容器内进行下列反应:
2SO2(g)+O2(g) 2SO3(g) △H=―190 kJ·mol—1
2SO3(g) △H=―190 kJ·mol—1
⑴该反应500℃时的平衡常数________450℃时的平衡常数(填“>”、“<”或“=”)。
⑵判断该反应达到平衡状态的标志是_______________。(填字母)
a.SO2和SO3浓度相等 b.SO2百分含量保持不变
c.容器中气体的压强不变 d.v(O2)正=2v(SO3)逆
e.容器中混合气体的密度保持不变
⑶欲提高SO2的转化率,下列措施可行 的是_______________。(填字母)
的是_______________。(填字母)
a.向装置中再充入N2 b.向装置中再充入O2
c.改变反应的催化剂 d.升高温度
⑷在一个固定容积为5 L的密闭容器中充入0.20 mol SO2和0.10 mol O2,半分钟后达到平衡,测得容器中含SO3 0.18 mol;若继续通入0.20 mol SO2和0.10 mol O2,则平衡_________________移动(填“向正反应方向”、“向逆反应方向”或“不”),再次达到平衡后,______ mol<n(SO3)<______mol。
在80 ℃时,将0.40 mol的N2O4气体充入2 L已经抽空的固定容积的密闭容器中,发生如下反应:N2O4(g) 2NO2(g)ΔH >0,隔一段时间对该容器内的物质进行分析,得到如下数据:
2NO2(g)ΔH >0,隔一段时间对该容器内的物质进行分析,得到如下数据:
| 时间/s n/mol |
0 |
20 |
40 |
60 |
80 |
100 |
| n(N2O4) |
0.40 |
a |
0.20 |
c |
d |
e |
| n(NO2) |
0.00 |
0.24 |
b |
0.52 |
0.60 |
0.60 |
(1)计算20~40 s内用N2O4表示的平均反应速率为____________mol· L-1·s-1。
(2)计算在80 ℃时该反应的平衡常数K=___________。
(3)反应进行至100 s后将反应混合物的温度降低,混合气体的颜色___________(填“变浅”“变深”或“不变”)。
(4)要增大该反应的K值,可采取的措施有___________(填序号)。
| A.增大N2O4的起始浓度 | B.向混合气体中通入NO |
| C.使用高效催化剂 | D.升高温度 |
(5)如图是80 ℃时容器中N2O4物质的量的变化曲线,请在该图中补画出该反应在60 ℃时N2O4物质的量的变化曲线。
(14分)某化学反应2A B+D在四种不同条件下进行,B、D的起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
B+D在四种不同条件下进行,B、D的起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
根据上述数据,完成下列填空:
(1)在实验1,反应在10至20分钟时间内平均速率V(B)为 mol/(L·min)。
(2)在实验2,A的初始浓度C2= mol/L,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是 。
(3)设实验3的反应速率为V3,实验1的反应速率为V1,则V3 V1(填>、=、<),且C3 1.0mol/L(填>、=、<)
(4)比较实验4和实验1,可推测该反应是 反应(选填吸热、放热)。
某经济开发区将钛冶炼厂与氯碱厂、甲醇厂组成了一个产业链,大大地提高了资源利用率,减少了环境污染。其流程如下: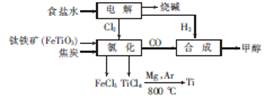
请回答下列问题:
(1)由CO和H2合成甲醇的化学方程式是CO(g)+2H2(g) CH3O(H(g)。若在恒容密 闭容器中充入一定量的CO和H2,在一定条件下反应,能说明该反应已达到平衡状态的是
CH3O(H(g)。若在恒容密 闭容器中充入一定量的CO和H2,在一定条件下反应,能说明该反应已达到平衡状态的是
(填字母)。
a.容器内压强保持不变 b.容器内气体密度保持不变
c.c(CO)=c(CH3OH) d.V正(CO)=v逆(CH3OH)
(2)写出流程中氯化时发生反应的化学方程式: 。
(3)20℃时,电解饱和食盐水制得烧碱的混合液中,随着NaOH含量的变化,NaCl达到饱和状态时其溶质质量分数的变化曲线如图所示。现有20℃时,满足曲线上B点所示的溶液,要降低溶液中NaCl的含量,可采用的方法是 。若向B点所示溶液中通入Cl2至恰好呈中性,此时溶液中各离子浓度从大到小的顺序为 。
(4)在某次联合生产过程中,氯碱厂电解电路中通过了20mol电子,同时甲醇厂获得了147.2g甲醇,则理论上冶钛厂可得钛 g(精确到0.1,下同),甲醇厂CO的转化率为 。
化学学科中的平衡理论主要内容包括:化学平衡、电离平衡、水解平衡和溶解平衡等四种。且均符合勒夏 特列原理。请回答下列问题。
特列原理。请回答下列问题。
(1)一定温度下,在一个固定容积的密闭容器中,可逆反应
A(g)+2B(g) 4C(g)
4C(g)  H >0 达到平衡时,c(A)="2mol/L," c(B)="7mol/L," c(C)=4mol/L。试确定B的起始浓度c(B)的取值范围是 ;若改变条件重新达到平衡后体系中C的体积分数增大,下列措施可行的是
H >0 达到平衡时,c(A)="2mol/L," c(B)="7mol/L," c(C)=4mol/L。试确定B的起始浓度c(B)的取值范围是 ;若改变条件重新达到平衡后体系中C的体积分数增大,下列措施可行的是
①增加C的物质的量 ②加 压 ③升 温 ④使用催化剂
(2)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如右图所示。则图中表示醋酸溶液中pH变化曲线的是 (填“A”或“B”)。设盐酸中加入的Zn质量为m1, 醋酸溶液中加入的Zn质量为m2。则m1 m2(选填“<”、“=”、“>”)
(6分)可逆反应①X(g)+2Y(g)  2Z(g) 、②2M(g)
2Z(g) 、②2M(g)  N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:
N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:
则X(g)+2Y(g)  2Z(g)正反应为 反应(填“放热”或“吸热”)达到平衡(Ⅰ)时X的转化率为 (保留小数点后两位数字,下同);假设平衡(Ⅰ)时左边容器(X、Y、Z的体系)的体积为2L,求此温度下的化学平衡常数
2Z(g)正反应为 反应(填“放热”或“吸热”)达到平衡(Ⅰ)时X的转化率为 (保留小数点后两位数字,下同);假设平衡(Ⅰ)时左边容器(X、Y、Z的体系)的体积为2L,求此温度下的化学平衡常数
工业上用CO生产燃料甲醇。一定条件下发生反应:CO(g)+2H2(g) CH3OH(g)。图1表
CH3OH(g)。图1表 示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化。
示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化。
请回答下列问题:
(1)在“图1”中,曲线 (填:a或b)表示使用了催化剂;该反应属于 (填:吸热、放热)反应。
(2)下列说法正确的是
| A.起始充入的CO为2mol |
| B.增加CO浓度,CO的转化率增大 |
| C.容器中压强恒定时,反应已达平衡状态 |
| D.保持温度和密闭容器容积不变,再充入1molCO和2molH2,再次达到平衡时n(CH3OH)/n(CO)会减小 |
(3)从反应开始到建立平衡, v(H2)=____ ____ ;该温度下CO(g)+2H2(g)  CH3OH(g)的化学平衡常数为______________ 。若保持其它条件不变,将反应体系升温,则该反应化学平衡常数____ (填“增大”、“减小”或“不变”)。
CH3OH(g)的化学平衡常数为______________ 。若保持其它条件不变,将反应体系升温,则该反应化学平衡常数____ (填“增大”、“减小”或“不变”)。
(4)请在“图3”中画出平衡时甲醇百分含量(纵坐标)随温度(横坐标)变化的曲线,要求画压强不同的2条曲线(在曲线上标出P1、P2,且P1<P2)。
(5)已知CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) ΔH=-192.9kJ/mol
又知H2O(l)= H2O(g) ΔH=+44 kJ/mol,请写出32g的CH3OH(g)完全燃烧生成液态水的热化学方程式 。
在一个容积不变的反应容器中,可以通过调节温度使下列反应:A(g)+2B(g) 2C(g) 达到平衡时保持容器内气体的总物质的量为15 mol。现向反应容器中加6.5 mol A、X mol B、4 mol C。
2C(g) 达到平衡时保持容器内气体的总物质的量为15 mol。现向反应容器中加6.5 mol A、X mol B、4 mol C。
(1)若X=5.5时需要降低体系温度才能使反应达平衡时符合题设条件,则正反应为_________反应。(填“吸热”或“放热”)
(2)欲使该反应起始时维持逆向移动,则X的取值范围_________________________。
自然界的矿物、岩石的成因和变化受到许多条件的影响。地壳内每加深1km,压强增大约25000~30000 kPa。在地壳内SiO2和HF存在以下平衡:SiO2(s) +4HF(g) SiF4(g)+ 2H2O(g) △H =-148.9 kJ·mo1-1
SiF4(g)+ 2H2O(g) △H =-148.9 kJ·mo1-1
根据题意完成下列填空:
(1)在地壳深处容易有 气体逸出,在地壳浅处容易有 沉积。
(2)如果上述反应的平衡常数K值变大,该反应 (选填编号)。(3分)
a.一定向正反应方向移动 b.在平衡移动时正反应速率先增大后减小
c.一定向逆反应方向移动 d.在平衡移动时逆反应速率先减小后增大
(3)若反应的容器容积为2.0L,反应时间8.0 min,容器内气体的密度增大了0.12 g/L,在这段时间内HF的平均反应速率为 。(3分)
向绝热恒容密闭容器中通入SO2和NO2,在一定条件下使反应
SO2(g)+NO2(g) SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如下所示。
SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如下所示。
(1)点a-c段,速率变化的主要原因是 ,点c后速率变化的主要原因是 。
(2)c点是否已经达到平衡状态 (填“是”、“否”或“不一定”)
(3)反应物浓度:a点 b点(填“<”、“=”或“>”)
(4)反应物的总能量 生成物的总能量(填“<”、“=”或“>”)
(5)△t1=△t2时,SO2物质的量的变化量:a~b段 b~c段(填“<”、“=”或“>”)
(14分)近年来,我闽许多地区气候异常现象频发,如:云南持续几个月的干旱、北方频发的沙尘暴等,使环境问题再次成为公众的焦点 是对环境影响较大的儿种气体,对它们的合理控制和治理是优化我们生存环境的有效途径。
是对环境影响较大的儿种气体,对它们的合理控制和治理是优化我们生存环境的有效途径。
(1)下列做法中,有利于降低大气中的 浓度的有__________ (选填字母)。
浓度的有__________ (选填字母)。
a. 直接用煤做燃料
b. 开私家车
c. 棺树造林以增加绿化面积
d. 研究、幵发太阳能使之走进寻常百姓家
(2 )用CO和H2做原料可以合成甲醇,作为液体燃料。已知: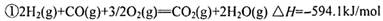
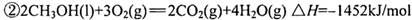
请写出用合成气(CO和H2)合成1mol液态甲醇的热化学反应方程式:__________
(3) 利用电化学原理将CO、SO2R化为重要化工原料,装置如图所示: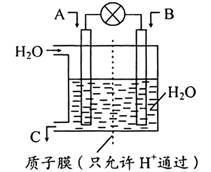
①若A为CO,B为H2, C为CH3OH,则通入CO的一极为_____极
②若A为SO2,B为O2,C为H2SO4,则负极的电极反应式为:__________
(4) ①已知:密闭容器中,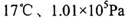 条件下,
条件下,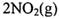
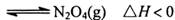 ,其平衡常数K=13.3。
,其平衡常数K=13.3。
当此反应达到平衡时,若 ,则
,则 =_______________(保留两位有效数字)。
=_______________(保留两位有效数字)。
②若改变上述体系的某个条件,达到新的平衡后,测得混合气体屮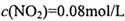 ,
, ,则改变的条件是____________________
,则改变的条件是____________________
试题篮
()