用NH3催化还原NxOy可以消除氮氧化物的污染。
已知:反应I: 4NH3(g)+6NO(g)  5N2(g)+6H2O(l) △H1
5N2(g)+6H2O(l) △H1
反应II: 2NO(g)+O2(g)  2NO2(g) △H2(且|△H1| =2|△H2|)
2NO2(g) △H2(且|△H1| =2|△H2|)
反应III:4NH3(g)+6NO2(g)  5N2(g)+3O2(g)+6H2O(l) △H3
5N2(g)+3O2(g)+6H2O(l) △H3
反应I和反应II在不同温度时的平衡常数及其大小关系如下表
| 温度/K |
反应I |
反应II |
已知: |
| 298 |
K1 |
K2 |
|
| 398 |
K1′ |
K2′ |
(1)△H3 = (用△H1、△H2 的代数式表示);推测反应III是 反应(填“吸热”或“放热”)
(2)相同条件下,反应I在2L密闭容器内,选用不同的催化剂,反应产生N2的量随时间变化如图所示。

①计算0~4分钟在A催化剂作用下,反应速率v(NO)= 。
②下列说法不正确的是 。
A.单位时间内H-O键与N-H键断裂的数目相等时,说明反应已经达到平衡
B.若在恒容绝热的密闭容器中发生反应,当K值不变时,说明反应已经达到平衡
C.该反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea(C)
D.增大压强能使反应速率加快,是因为增加了活化分子百分数
(3)一定条件下,反应II达到平衡时体系中n(NO)∶n(O2)∶n(NO2)=2∶1∶2。恒温恒压时,在其它条件不变时,再充入NO2气体, NO2体积分数 (填“变大”、“变小”或“不变”)
(4)电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如下,溶液中OH-向电极 移动(填a或b),负极的电极反应式为 。

工业合成氨与制备硝酸一般可连续生产,流程如图所示:

(1)工业生产时,制取氢气的一个反应为:CO+H2O(g) CO2+H2
CO2+H2
T℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。该温度下此反应的平衡常数K=" _____" (填计算结果)。
(2)合成塔中发生反应N2(g)+3H2(g) 2NH3(g);△H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中T1 ___ 573K(填“>”、“<”或“=”)。
2NH3(g);△H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中T1 ___ 573K(填“>”、“<”或“=”)。
| T/℃ |
T1 |
300 |
T2 |
| K |
1.00×107 |
2.45×105 |
1.88×103 |
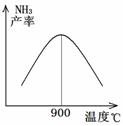
(3)N2和H2以铁作催化剂从145℃就开始反应,不同温度下NH3的产率如图所示。温度高于900℃时,NH3产率下降的原因是 。
(4)硝酸厂的尾气直接排放将污染空气,目前科学家探索利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为:
CH4(g)+4NO2=(g)=4NO(g)+CO2(g)+2H2O(g); △H=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g); △H=-1160kJ·mol-1
则甲烷直接将NO2还原为N2的热化学方程式为:
(5)氨气在纯氧中燃烧,生成一种单质和水。科学家利用此原理,设计成氨气-氧气燃料电池,则通入氨气的电极碱性条件下发生反应的电极反应式为 。
肼(N2H4)与N2O4,是火箭发射中最常用的燃料与助燃剂。
(1)已知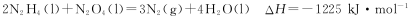
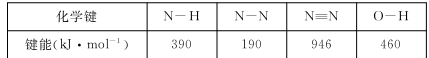
则使1 mol N2O4 (l)完全分解成相应的原子时需要吸收的能量是 。
(2)800℃时,某密闭容器中存在如下反应: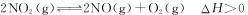 ,若开始向容器中加入1 mol/L的NO2,反应过程中NO的产率随时间的变化如下图曲线I所示。
,若开始向容器中加入1 mol/L的NO2,反应过程中NO的产率随时间的变化如下图曲线I所示。
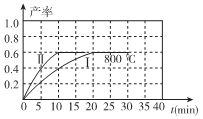
①反应Ⅱ相对于反应I而言,改变的条件可能是 。
②请在图中绘制出在其它条件与反应I相同时,反应在820℃时进行,NO的产率随时间的变化曲线。
③800℃时,若开始时向容器中同时加入1 mol/L NO、0.2 mol/L O2、0.5 mol/L NO2,则v(正)____v(逆)。
(3)己知 ,t时,将一定量的NO2、N2O4,充人一个容器为2L的恒容密闭容器中,浓度随时间变化关系如下表所示:
,t时,将一定量的NO2、N2O4,充人一个容器为2L的恒容密闭容器中,浓度随时间变化关系如下表所示:
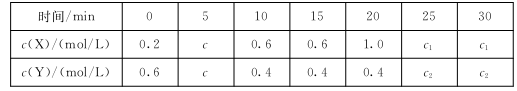
①c( X)代表 (填化学式)的浓度,该反应的平衡常数K= 。
②前10 min内用NO2表示的反应速率为 ,20 min时改变的条件是 ;重新达到平衡时,NO2的百分含量 (填选项前字母)。
a.增大 b.减小 c.不变 d.无法判断
降低大气中CO2的含量及有效地开发利用 CO2,目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在一定体积的恒容密闭容器中,充入1molCO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=﹣49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示.
CH3OH(g)+H2O(g)△H=﹣49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示.

(1)从反应开始到平衡,氢气的平均反应速率v(H2)= mol/(L•min);
(2)氢气的转化率= ;
(3)下列措施中能使平衡体系中 减少的是 .
减少的是 .
A.将H2O(g)从体系中分离出去
B.充入He(g),使体系压强增大
C.升高温度
D.再充入1molH2
(4)下列不能表示反应达到平衡状态的是
A.体系压强不再改变
B.混合气体的密度不再改变
C.容器内的温度不再改变
D.混合气体的平均分子质量不再改变
E.V(CO2):V(H2O)=1:1
F.混合气体的总物质的量不再改变
煤化工中两个重要反应为①C(s)+H2O(g) H2(g)+CO(g) ΔH=+131.3 kJ·mol-1,②CO(g)+ H2O(g)
H2(g)+CO(g) ΔH=+131.3 kJ·mol-1,②CO(g)+ H2O(g) CO2(g) + H2(g)。
CO2(g) + H2(g)。
(1)下列说法正确的是 。
| A.当反应①的容器中混合气体的密度不再变化时反应达到最大限度 |
| B.反应②的熵变△S >0 |
| C.反应①中增加C固体的量能增大反应速率 |
| D.在反应中②及时分离出产生的H2对正反应速率无影响 |
(2)若工业上要增加反应①的速率,最经济的措施为 。
(3)现将不同量的CO(g)和H2O(g)分别通入2L恒容密闭容器中进行反应,得到如下三组数据:
| 实验组] |
温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡所 需时间/ min |
||
| CO |
H2O |
H2 |
CO2 |
|||
| I |
650 |
4 |
2 |
1.6 |
1.6 |
5 |
| Ⅱ |
900 |
2 |
1 |
0.5 |
0.5 |
3 |
| Ⅲ |
900 |
a |
b |
c |
d |
t |
①实验I中,从反应开始到反应达到平衡时,H2O的平均反应速率为___。
②CO(g)和H2O(g)反应的△H 0(填“大于”、“小于”或“等于”)
③实验III中,若平衡时,CO的转化率大于水蒸气,则a、b必须满足的关系是_____,与实验Ⅱ相比,化学平衡常数 (填“增大”、“减小”或“不变”)。
④若在900℃时,实验II反应达到平衡后,向此容器中再加入1 mol CO、0.5 mol H2O、0.2 mol CO2、0.5 mol H2,平衡向________方向移动(填“正反应”、“逆反应”“不移动”)。
(4)CO、H2可用于甲醇和甲醚,其反应为(m、n均大于0):
反应①:CO(g)+2H2(g) CH3OH(g) ΔH= -mkJ·mol-1
CH3OH(g) ΔH= -mkJ·mol-1
反应②: 2CO(g)+4 H2(g) CH3OCH3(g) +H2O(g) ΔH=-nkJ·mol-1
CH3OCH3(g) +H2O(g) ΔH=-nkJ·mol-1
反应③:2CH3OH(g) CH3OCH3(g)+ H2O(g) △H<0
CH3OCH3(g)+ H2O(g) △H<0
则m与n的关系为 。
合成氨是人类科学技术上的一项重大突破,工业上以天然气为原料合成氨。其生产
工艺如下:造气阶段→转化阶段→分离净化→合成阶段
(1)造气阶段的反应为:CH4(g)+H2O(g)  CO(g)+3H2(g) ΔH=+206.1 kJ/mol
CO(g)+3H2(g) ΔH=+206.1 kJ/mol
①在一个密闭容器中进行上述反应, 测得CH4的物质的量浓度随反应时间的变化如下图1所示,10min时,改变的外界条件可能是 。
②如图2所示,在初始容积相等的甲、乙两容器中分别充入等物质的量的CH4和H2O。在相同温度下发生反应,并维持反应过程中温度不变。则达到平衡时,两容器中CH4的转化率大小关系为:α甲(CH4)
α乙(CH4)

(2)转化阶段发生的可逆反应为:CO(g)+H2O(g) CO2(g)+H2(g),在一定温度下,反应的平衡常数为K=1。某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
CO2(g)+H2(g),在一定温度下,反应的平衡常数为K=1。某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
| CO |
H2O |
CO2 |
H2 |
| 0.5 mol |
8.5 mol |
2.0 mol |
2.0 mol |
此时反应中正、逆反应速率的关系式是 (填序号)。
a.v(正)>v(逆) b.v(正)<v(逆) c.v(正)=v(逆) d.无法判断
(3)合成氨反应为:N2(g)+3H2(g) 2NH3(g) ∆H=-92.4kJ/mol,根据勒夏特列原理,简述提高合成氨原料转化率的一种方法 。
2NH3(g) ∆H=-92.4kJ/mol,根据勒夏特列原理,简述提高合成氨原料转化率的一种方法 。
(4)工业合成氨的热化学方程式为N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1。在某压强恒定的密闭容器中加入2mol N2和4mol H2,达到平衡时,N2的转化率为50%,体积变为10 L。求:
2NH3(g) ΔH=-92.4 kJ·mol-1。在某压强恒定的密闭容器中加入2mol N2和4mol H2,达到平衡时,N2的转化率为50%,体积变为10 L。求:
①该条件下的平衡常数为_________;
②若向该容器中加入a mol N2、b mol H2、c mol NH3,且a、b、c 均大于0,在相同条件下达到平衡时,混合物中各组分的物质的量与上述平衡相同。反应放出的热量__________(填“>”“<”或“=”)92.4 kJ。
③在一定温度下,在一个容积不变的密闭容器中,发生合成氨反应,下列能判断该反应达到化学平衡状态的是____________
a.v(N2)=3v(NH3)
b.混合气体的密度不随时间改变
c.混合气体的平均相对分子质量不随时间改变
d.容器中的压强不随时间改变
e.c(N2)=c(NH3)
工业合成氨与制备硝酸一般可连续生产,流程如图所示:

(1)工业生产时,制取氢气的一个反应为:CO+H2O(g) CO2+H2 T℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。该温度下此反应的平衡常数K=_____(填计算结果)。
CO2+H2 T℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。该温度下此反应的平衡常数K=_____(填计算结果)。
(2)合成塔中发生反应N2(g)+3H2(g) 2NH3(g);△H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中T1____300℃(填“>”、“<”或“=”)。
2NH3(g);△H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中T1____300℃(填“>”、“<”或“=”)。

(3)N2和H2以铁作催化剂从145℃就开始反应,不同温度下NH3的产率如右图所示。温度高于900℃时,NH3产率下降的原因是 。

(4)硝酸厂的尾气直接排放将污染空气,目前科学家探索利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g); △H=-574kJ·mol-1;
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g); △H=-1160kJ·mol-1
则甲烷直接将NO2还原为N2的热化学方程式为: 。
(5)氨气在纯氧中燃烧,生成一种单质和水。科学家利用此原理,设计成氨气-氧气燃料电池,则通入氨气的电极碱性条件下发生反应的电极反应式为 。
(Ⅰ).A、B、C、D、E、F是六种短周期主族元素,它们的原子序数依次增大,其中C、F分别是同一主族元素,A、F两种元素的原子核中质子数之和比C、D两种元素原子核中质子数之和少2,F元素的最外层电子数是次外层电子数的0.75倍。又知B元素的最外层电子数是内层电子数的2倍,E元素的最外层电子数等于其电子层数。请回答:
(1)1 mol由E、F二种元素组成的化合物跟由A、C、D三种元素组成的化合物反应生成两种盐和水,完全反应后消耗后者的物质的量为 。
(2)A、C、F间可以形成甲、乙两种负一价双原子阴离子,甲有18个电子,乙有10个电子,则甲与乙反应的离子方程式为 ;
(3)科学研究证明:化学反应热只与始终态有关,与过程无关。单质B的燃烧热为a kJ/mol。由B、C二种元素组成的化合物BC 14g完全燃烧放出热量b kJ,写出单质B和单质C反应生成BC的热化学方程式: ;
(4)工业上在高温的条件下,可以用A2C与BC反应制取单质A2。在等体积的I、II两个密闭容器中分别充入1 molA2C和1mol BC、2 mol A2C和2 mol BC。一定条件下,充分反应后分别达到平衡(两容器温度相等)。下列说法正确的是 。
A.达到平衡所需要的时间:I>II
B.达到平衡后A2C的转化率:I=II
C.达到平衡后BC的物质的量:I>II
D.达到平衡后A2的体积分数:I<II
(5)用B元素的单质与E元素的单质可以制成电极浸入由A、C、D三种元素组成化合物的溶液中构成电池,则电池负极反应式为 。
(Ⅱ).A、B、C、D、E、F是短周期元素组成的中学常见的物质,他们的转化关系如图所示(部分反应条件略去):
(1)若所有转化都是非氧化还原反应,B、D、E含有同种金属元素,F为强碱(部分产物略去),则B+D→E的离子方程式为 ,C为同周期元素构成的1:1型化合物,则C的电子式为 。

(2)若A、D、F为单质,B、C、E为化合物,B为两种非金属元素所组成的化合物,则E的化学式为 。A+B→C+D的化学方程式为 。
随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视。目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在485℃时,在体积为1 L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应合成甲醇:
(1)请完成CO2和3mol H2反应合成甲醇的热化学方程式:
CO2(g)+3H2(g)  CH3OH(g)+______( ),△H=-49.0kJ/mol
CH3OH(g)+______( ),△H=-49.0kJ/mol
(2)测得CO2和CH3OH(g)的浓度随时间变化如图所示。

①从反应开始到平衡,氢气的平均反应速率v(H2)= ___________mol/(L·min)。
②该反应的平衡常数表达式为__________________。
③据图中提供的数据计算在该温度下的K值。要有计算过程。(保留三位有效数字)
(3)能判断该反应是否达到化学平衡状态的依据是___________(多选扣分)
A.容器中压强不变的状态 B.混合气体中c(CO2)不变的状态
C.V逆(H2O)="3" V正(H2) D.混合气体的密度保持不变的状态
E.用CO2、H2、CH3OH的物质的量浓度变化表示的反应速率的比为1:3:1的状态
F.混合气体的平均相对分子质量不再改变的状态
(4)下列措施中能使n(CH3OH)/n(CO2)增大的是___________。
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.再充入1mol CO2和3mol H2
“洁净煤技术”研究在世界上相当普遍,科研人员通过向地下煤层气化炉中交替鼓入空气和水蒸气的方法,连续产出了高热值的煤炭气,其主要成分是CO和H2。CO和H2可作为能源和化工原料,应用十分广泛.生产煤炭气的反应之一是:C(s)+H2O(g) CO(g)+H2(g) H=+131.4kJ/mol
CO(g)+H2(g) H=+131.4kJ/mol
(1)在容积为3L的密闭容器中发生上述反应,5min后容器内气体的密度增大了0.12g/L,用H2O表示0~5min的平均反应速率为______________。
(2)关于上述反应在化学平衡状态时的描述正确的是___________.
A.CO的含量保持不变
B.v正(H2O)=v正(H2)
C.容器中混合气体的平均相对分子质量保持不变
(3)若上述反应在t0时刻达到平衡(如图),在t1时刻改变某一条件,请在图中继续画出t1时刻之后正反应速率随时间的变化:
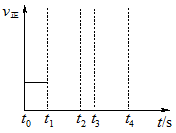
①缩小容器体积,t2时到达平衡(用实线表示);
②t3时平衡常数K值变大,t4到达平衡(用虚线表示).
(4)在一定条件下用CO和H2可以制得甲醇,CH3OH和CO的燃烧热分别为725.8kJ/mol,283.0kJ/mol,1molH2O(l)变为H2O(g)吸收44.0 kJ的热量,写出甲醇不完全燃烧生成一氧化碳和气态水的热化学方程式_______________________
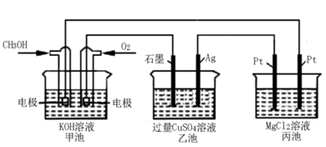
(5)如下图所示,以甲醇燃料电池作为电源实现下列电解过程.乙池中发生反应的离子方程式为_____________。当甲池中增重16g时,丙池中理论上产生沉淀质量的最大值为_________g。
化学反应原理在生产和科研中有重要的应用,请利用相关知识回答下列问题。
I.常温下I2O5(s)可用于检测CO,反应原理为:5CO(g)+I2O5(s)  5CO2(g)+I2(s) △H<0.一定温度下,向2L恒容密闭容器中加入足量I2O5(s),并通入1molCO。反应中CO2的体积分数φ(CO2)随时间的变化如图所示:
5CO2(g)+I2(s) △H<0.一定温度下,向2L恒容密闭容器中加入足量I2O5(s),并通入1molCO。反应中CO2的体积分数φ(CO2)随时间的变化如图所示:

(1)该反应的平衡常数表达式K=__________;
(2)0~0.5min内的平均反应速率v(CO)=_________;
(3)下列叙述能说明反应达到平衡的是( )
A.容器内压强不再变化
B.CO的质量不再变化,CO2的转化率不再增大
C.CO2的生成速率等于CO的消耗速率,反应物不再转化为生成物
D.混合气体的平均相对分子质量不再改变
(4)保持温度和体积不变,若开始加入CO(g)的物质的量是原来的2倍,则下列说法正确的是( )
A.平衡时生成I2的质量为原来的2倍
B.达到平衡的时间为原来的2倍
C.平衡时混合气体的物质的量为原来的2 倍
D.平衡时混合气体的密度不变
II.一定条件下在密闭容器中加入NH4I发生反应:A.NH4I(s) NH3(g)+HI(g),
NH3(g)+HI(g),
B.2HI(g)  H2(g)+I2(g)。达到平衡后,扩大容器体积,反应b 的移动方向___________(填正向、逆向或不移动);
H2(g)+I2(g)。达到平衡后,扩大容器体积,反应b 的移动方向___________(填正向、逆向或不移动);
III.己知:2NO2 N2O4 △H<0,将一定量的NO2充入注射器中后封口,下图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是( )
N2O4 △H<0,将一定量的NO2充入注射器中后封口,下图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是( )

A.b点的操作是压缩注射器
B.c点与a点相比,c(NO2)增大,c(N2O4)减小
C.若反应在一绝热容器中进行,则b、c两点的平衡常数Kb>Kc
D.d点:v(正)>v(逆)
(1)现有可逆反应.2NO2(g) N2O4(g),△H<0,试根据下列图象判断t2、t3、t4时采取的措施。
N2O4(g),△H<0,试根据下列图象判断t2、t3、t4时采取的措施。
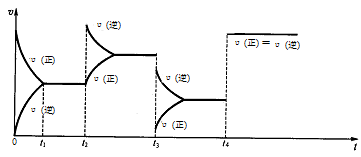
t2: ;
t3: ;t4: 。
在80℃时,将0.4mol的四氧化二氮气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
| 时间(s) C(mol/L) |
0 |
20 |
40 |
60 |
80 |
100 |
| C(N2O4) |
0.20 |
a |
0.10 |
c |
d[] |
e |
| C(NO2) |
0.00 |
0.12 |
b |
0.22 |
0.22 |
0.22 |
(2)40s时,NO2的产率是 。
(3)20s时,N2O4的浓度为 mol/L,0~20s内N2O4的平均反应速率为 。
(4)在80℃时该反应的平衡常数K值为 (保留2位小数)。
(5)在其他条件相同时,该反应的K值越大,表明建立平衡时 。
A、N2O4的转化率越高 B、NO2的产量越大
C、N2O4与NO2的浓度之比越大 D、正反应进行的程度越大
(6)利用甲烷催化还原NOx:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574 kJ/mol
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H2=-1160 kJ/mol
则甲烷直接将NO2还原为N2的热化学方程式为:__ 。
I.(1)对反应N2O4(g) 2NO2(g) △H>0 ,在温度为T1、 T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。T1 T2(填“>”、“<”或“=”);A、C两点的速率VA VC(同上)。
2NO2(g) △H>0 ,在温度为T1、 T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。T1 T2(填“>”、“<”或“=”);A、C两点的速率VA VC(同上)。

(2)在100℃时,将0.400mol的NO2气体充入2L真空定容密闭容器中,
每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
| 时间(s) |
0 |
20 |
40 |
60 |
80 |
| n(NO2)/mol |
0.40 |
n1 |
0.26 |
n3 |
n4 |
| n(N2O4)/mol |
0.00 |
0.05 |
n2 |
0.08 |
0.08 |
①该反应的平衡常数K的值为 ;
②若在相同情况下最初向该容器充入的是N2O4,要达到上述同样的平衡状态,N2O4的起始浓度是_____________mol/L。
③计算②中条件下达到平衡后混合气体的平均相对分子质量为 ;(结果保留小数点后一位)
II. 在0.5 L的密闭容器中,一定量的H2和N2进行如下化学反应:3H2(g)+N2(g) 2NH3(g) △H <0,其化学平衡常数K与温度t的关系如下表。请回答下列问题。
2NH3(g) △H <0,其化学平衡常数K与温度t的关系如下表。请回答下列问题。
| t/℃ |
200 |
300 |
400 |
| K |
K1 |
K2 |
0.5 |
④比较K1,K2的大小,K1_________K2(填写“ >”、“=”或“<”)。
⑤在400℃时,当测得NH3和N2、H2的物质的量分别为3mol和1 mol、2 mol时,则该反应的V(H2)正_________ V (H2)逆(填写“>”、“=”或“<”)。
在密闭容器中进行反应①Fe(s)+CO2(g) FeO(s)+CO(g) ΔH1=akJ·mol一1
FeO(s)+CO(g) ΔH1=akJ·mol一1
反应②2CO(g)+O2(g) 2CO2(g) △H2="b" kJ·mol-1
2CO2(g) △H2="b" kJ·mol-1
反应③2Fe(s)+O2(g) 2FeO(s) △H3
2FeO(s) △H3
(1) △H3= (用含a、b的代数式表示)。
(2)反应①的化学平衡常数表达式K= ,已知500℃时反应①的平衡常数K=1.0,在此温度下2 L密闭容器中进行反应①,Fe和CO2的起始量均为2.0 mol,达到平衡时CO2的转化率为 ,CO的平衡浓度为 。
(3)将上述平衡体系升温至700℃,再次达到平衡时体系中CO的浓度是CO2浓度的两倍,则a 0(填“>”、“<”或“=”)。为了加快化学反应速率且使体系中CO的物质的量增加,其他条件不变时,可以采取的措施有 (填序号)。
| A.缩小容器的体积 | B.再通入CO2 |
| C.升高温度 | D.使用合适的催化剂 |
(4)下列图像符合反应①的是 (填序号)(图中V是速率、φ为混合物中CO含量,T为温度)。

(1)在一容积为10L的容器中,通入一定量的CO和H2O,在850℃时发生反应CO(g)+H2O(g) CO2(g)+H2(g) △H<0,CO和H2O浓度变化如图,则0~4min的平均反应速率v(CO)= mol·L-1·min-1,850℃时,此反应的平衡常数为 ,CO的转化率为 。
CO2(g)+H2(g) △H<0,CO和H2O浓度变化如图,则0~4min的平均反应速率v(CO)= mol·L-1·min-1,850℃时,此反应的平衡常数为 ,CO的转化率为 。

(2) ℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如下表:
℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如下表:
| t/min |
c(CO)/mol·L-1 |
c(H2O)/mol·L-1 |
c(CO2)/mol·L-1 |
c(H2)/mol·L-1 |
| 0 |
0.200 |
0.300 |
0 |
0 |
| 2 |
0.138 |
0.238 |
0.062 |
0.062 |
| 3 |
c1 |
c2 |
c3 |
c3 |
| 4 |
c1 |
c2 |
c3 |
c3 |
| 5 |
0.116 |
0.216 |
0.084 |
|
| 6 |
0.096 |
0.266 |
0.104 |
|
①从表中看出,3~4min之间反应处于 状态;c1 0.08(填“大于”、“小于”或“等于”)。
②反应在4~5min间,平衡向逆反应方向移动,可能的原因是 ,表中5~6min之间数值发生变化,可能的原因是 。
a.降低温度 b.增加水蒸气
c.增加氢气浓度 d.使用催化剂
试题篮
()