(本题8分)对于反应xA(g)+yB(g) pC(g)+qD(g)压强与温度对C的质量分数的影响如图:
pC(g)+qD(g)压强与温度对C的质量分数的影响如图:
(1)若m、n表示不同温度,则m n,正反应为 反应(填“放热”、“吸热”);
(2)若m、n表示不同压强,则m n,(x+y) (p+q)(填<、>、=);
(3)b曲线的OG段比a曲线的OH段陡的原是: ;
(4)a曲线的HE段高于b曲线的GF段的原是: 。
(12分)现有反应:mA(g)+nB(g) pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
(1)该反应的逆反应为_________热反应,且m +n ________ p(填“>”“=”“<”)。
(2)减压时,A的质量分数_________。(填“增大”“减小”或“不变”,下同)
(3)若加入B(体积不变),则A的转化率__________。
(4)若升高温度,则平衡时B、C的浓度之比 将_________。
将_________。
(5)若B是有色物质,A、C均无色,则加入C(体积不变)时混合物颜色_______ (填“变深”“变浅”或“不变”)。
在一定体积的密闭容器中,进行如下化学反应:
C(s)+H2O(g)  CO(g)+H2(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2(g),其化学平衡常数K和温度t的关系如下表:
| t/(℃) |
700 |
800 |
830 |
1000 |
1200 |
| K |
0.7 |
0.8 |
1.0 |
1.6 |
2.4 |
(1)该反应的化学平衡常数表达式为K=____ ____,该反应为________反应(填“吸热”或“放热”)。
(2)能作为判断反应达到化学平衡状态的依据是________。
A.容器中压强不变 B.c(H20)不变
C.v正(H2)=v逆(H2O) D.c(H2)=c(CO)
(3)830 ℃时,容器中的反应已达到平衡。在其他条件不变的情况下,缩小容器的体积,平衡________移动(填“正向”、“逆向”或“不”)。H2O(g)的浓度___ ____,CO(g)的浓度___ ____(填“变大”、“不变”或“变小”)
(8分)某温度时,在2 L容器中A、B两种物质间的转化反应中,A、B物质的量随时间变化的曲线如图所示,由图中数据分析得:
(1)该反应的化学方程式为____________________________________。
(2)反应开始至4 min时,A的平均反应速率为____________________________。
(3)4 min时,反应是否达到平衡状态?________(填“是”或“否”), 8 min时,v(正)________v(逆)(填“>”、“<”或“=”)。
合成尿素的反应为: 完成下列填空:
完成下列填空:
(1)写出NH3的电子式 ;画出碳原子结构示意图 ;氧元素位于周期表第 周期第 族。
(2)上述反应所涉及的4种元素,原子半径从大到小的排列顺序为 。
(3)上述反应所涉及的4种元素中,非金属性最强的是 。
(4)一定条件下,在10L的恒容密闭容器中,充入2mol NH3和1mol CO2,反应经5min后达到平衡,测得容器中水蒸气0.6mol,则平均反应速率v(NH3)= mol/(L·min)。
(5)下列能说明上述反应己达平衡的是 。(填序号)
a.2c(NH3)=c(H2O) b.CO2的浓度不变
c.v正(NH3):v正(CO2)=2:1 d.气体的压强不变
(6)为提高氨气的转化率,工业上用该反应生产尿素时,合适的反应条件是 。(填序号)
a.200℃ b.800℃ c.101kPa d.24000kPa
在一定体积的密闭容器中进行化学反应:CO2 (g)+H2(g)  CO(g) + H2O(g),其化学平衡常数K和温度的关系如下表所示:
CO(g) + H2O(g),其化学平衡常数K和温度的关系如下表所示:
| t/ |
700 |
800 |
830 |
1000 |
1200 |
| K |
0.6 |
0. 9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=______________。
(2)该反应为___________反应(填“吸热”或“放热”)。
(3)某温度下,平衡浓度符合下式:c (CO2)·c (H2) =" c" (CO) ·c (H2O),试判断此时的温度为_______
(4)能判断该反应是否达到化学平衡状态的依据是( )
A.容器中物质的量不变
B.混合气体中各物质的浓度不变
C.消耗nmolCO2的同时,生成了2nmolH2
D.c (CO2) =" c" (H2O)
( 10分)在密闭容器中进行下列反应:CO2(g)+C(s)  2CO(g) ΔH>0,起始通入2molCO,达到平衡后,改变下列条件,则指定物质的浓度、百分含量(填“不变”“增大”“减小”)及平衡如何变化(填“正移”“逆移”“不移动”):
2CO(g) ΔH>0,起始通入2molCO,达到平衡后,改变下列条件,则指定物质的浓度、百分含量(填“不变”“增大”“减小”)及平衡如何变化(填“正移”“逆移”“不移动”):
(1)增加C,平衡________,c(CO)________。
(2)减小密闭容器的体积,保持温度不变,则平衡______________,c(CO2)___ _____。
(3)通入N2,保持密闭容器的体积和温度不变,则平衡________,c(CO2)________。
(4)保持密闭容器的体积不变,升高温度,则平衡__________________,c(CO)________
(5)恒压通入N2,CO2的百分含量
(6)恒压再通入2molCO,CO2的百分含量
将一定量的SO2和含0.7mol氧气的空气(忽略CO2)放入一定体积的密闭容器中,550℃时,在催化剂作用下发生反应:2SO2+O2 2SO3 ΔH <0。反应达到平衡后,将容器中的混合气体通过过量NaOH溶液,气体体积减少了21.28L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6L(以上气体体积均为标准状况下的体积)。请回答下列问题:
2SO3 ΔH <0。反应达到平衡后,将容器中的混合气体通过过量NaOH溶液,气体体积减少了21.28L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6L(以上气体体积均为标准状况下的体积)。请回答下列问题:
(1)判断该反应达到平衡状态的标志是 。(填字母)
a.SO2和SO3浓度相等 b.SO2百分含量保持不变
c.容器中气体的压强不变 d.SO3的生成速率与SO2的消耗速率相等
e.容器中混合气体的密度保持不变
(2)欲提高SO2的转化率,下列措施可行的是 。(填字母)
a.向装置中再充入N2 b.向装置中再充入O2
c.改用效率更高的催化剂 d.升高温度
(3)求该反应达到平衡时SO2的转化率(用百分数表示)为____________。
(4)若将平衡混合气体的5%通入过量的BaCl2溶液,生成沉淀___________克?
乙苯催化脱氢制苯乙烯反应:
(1)已知:
| 化学键 |
C-H |
C-C |
C=C |
H-H |
| 键能/kJ·molˉ1 |
412 |
348 |
612[ |
436 |
计算上述反应的△H=____________ kJ·mol-1。
(2)维持体系总压强p恒定,在温度T时,物质的量为n、体积为V的乙苯蒸汽发生催化脱氢反应。已知乙苯的平衡转化率为α,则在该温度下反应的平衡常数K=____________(用含α等字母的代数式表示)。
二甲醚(CH3OCH3)被称为21世纪界的新型燃料,在未来可能替代汽油、液化气、煤气等并具有优良的环保性能。工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应:
①CO(g)+2H2(g) CH3OH(g) △H1=-90.7kJ·mol-1
CH3OH(g) △H1=-90.7kJ·mol-1
②2CH3OH(g) CH3OCH3(g) +H2O(g) △H2=-23.5kJ·mol-1
CH3OCH3(g) +H2O(g) △H2=-23.5kJ·mol-1
③CO(g)+H2O(g) CO2(g)+H2(g) △H3=-41.2kJ·mol-1
CO2(g)+H2(g) △H3=-41.2kJ·mol-1
(1)若要增大反应①中H2的转化率,在其它条件不变的情况下可以采取的措施为 。
| A.加入某物质作催化剂 | B.加入一定量CO |
| C.反应温度降低 | D.增大容器体积 |
(2)在某温度下,若反应①的起始浓度分别为:c(CO)=1 mol/L,c(H2)=2 mol/L,5 min后达到平衡,CO的转化率为50%,则5 min内CO的平均反应速率为 ;
若反应物的起始浓度分别为:c(CO)=4 mol/L,c(H2)=a mol/L;达到平衡后,c(CH3OH)=2 mol/L,
a= mol/L。
(3)催化反应室中总反应3CO(g)+3H2(g) CH3OCH3(g)+CO2(g)的△H = 。
CH3OCH3(g)+CO2(g)的△H = 。
密闭容器中mA(g)+nB(g)  pC(g),反应达到平衡,经测定增大压强P时,
pC(g),反应达到平衡,经测定增大压强P时,
A的转化率随P而变化的曲线如图。
则:(1)增大压强:A的转化率 ,平衡向 移动,达到平衡后,混合物中C的质量分数_____ 。
(2)上述化学方程式中的系数m、n、p的正确关系是 。
(3)降低温度,C的质量分数增大,则:平衡向 移动,A的转化率 ,正反应是 热反应。(以上各空用适当的化学用语或关系式填写)
在密闭容器中,使3 mol N2和6 mol H2混合发生下列反应:N2(g)+3H2(g)  2NH3(g) ΔH<0。已知平衡时NH3为nmol。回答下列问题:
2NH3(g) ΔH<0。已知平衡时NH3为nmol。回答下列问题:
(1)上述平衡中,N2和NH3的浓度比= (用含n的代数式表示);N2和H2的转化率之比=________。
(2)升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量________,密度___________ (填“变大”、“变小”或“不变”) 。
(3)当达到平衡时,充入氩气,并保持压强不变,平衡将________(填“正向”、“逆向”或“不”)移动。
(4)若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,达到新平衡后,容器内温度________(填“>”、“<”或“=”)原来的2倍。
I2可溶于KI溶液并存在下列平衡:I2(aq)+I-(aq) I3-(aq)。测得不同温度下该反应的平衡常数如右表。回答下列问题:
I3-(aq)。测得不同温度下该反应的平衡常数如右表。回答下列问题:
| t/℃ |
5 |
15 |
25 |
35 |
50 |
| K |
1100 |
841 |
680 |
533 |
409 |
(1)上述反应的ΔH 0(填“>”、“<”或“=”);
(2)上述平衡体系中加入苯,平衡向 方向移动(填“正反应”或“逆反应”);
(3)温度一定,向上述平衡体系中加入少量KI固体,平衡常数 (填“增大”或“减少”或“不变”)。
甲醇是一种可再生能源,在日常生活中有着广泛的应用.工业上用CO生产燃料甲醇,如:CO(g)+2H2(g)⇌CH3OH(g).图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化.
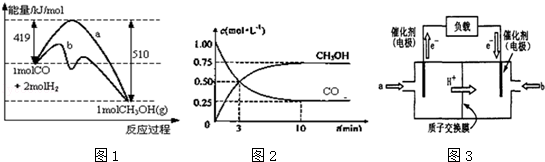
请回答下列问题:
(1)图1表示使用和未使用催化剂时反应过程和能量的对应关系.下列有关催化剂的说法不正确是
| A.降低分子的能量 |
| B.增加了活化分子数 |
| C.提高了活化分子百分数 |
| D.增加了单位体积内的活化分子数 |
(2)从反应开始到建立平衡,该过程中释放 kJ热量.
(3)在T2℃下,将2molCO和6molH2充入2L的密闭容器中,达到平衡状态时,测得C(CO)=0.2mol•L﹣1,则CO的转化率为 .
(4)如图3为常用笔记本电脑所用甲醇质子交换膜燃料电池的结构示意图如.电池总反应为2CH3OH+3O2⇌2CO2+4H2O.在电脑的使用过程中,电池的温度往往因为各种原因会升高.温度升高_____________(填:“有利于”或“不利于”)电池将化学能转化为电能.该装置中_____(填:“a”或“B”)为电池的负极,该电极反应式为 .
试题篮
()