下列改变一定能说明化学平衡发生移动的是( )
| A.反应混合物中各物质的浓度的改变 | B.反应物转化率的改变 |
| C.正逆反应速率的改变 | D.反应容器中压强的改变 |
在恒容密闭容器中存在下列平衡:

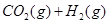 。
。 的平衡物质的量浓度
的平衡物质的量浓度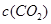 与温度T的关系如右图所示。下列说法错误的是( )
与温度T的关系如右图所示。下列说法错误的是( ) 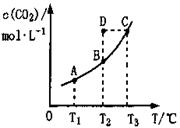
A.反应  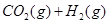 的 的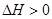 |
B.在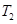 时,若反应处于状态 时,若反应处于状态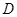 ,则一定有 ,则一定有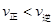 |
C.平衡状态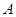 与 与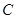 相比,平衡状态 相比,平衡状态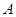 的 的 小 小 |
D.若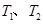 时的平衡常数分别为 时的平衡常数分别为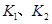 ,则 ,则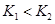 |
冰醋酸CH3COOH沸点较高(117.9℃),且能形成二聚物(CH3COOH)2,其反应式为2CH3COOH(g) (CH3COOH)2(g) (正反应为放热反应),若采用测气体密度的方法测醋酸相对分子质量,为尽量接近真实性,在测定时应采用
(CH3COOH)2(g) (正反应为放热反应),若采用测气体密度的方法测醋酸相对分子质量,为尽量接近真实性,在测定时应采用
| A.高温低压 | B.低温低压 | C.加催化剂 | D.低温高压 |
在已经处于化学平衡状态的体系中,如果下列量发生变化,其中一定能表明化学平衡移动的是
| A.反应混合物的浓度 | B.反应体系的压强 | C.正、逆反应的速率 | D.反应物的转化率 |
可逆反应N2(g)+3H2(g) 2NH3(g),△H=-Q KJ/mol(Q>0)。有甲、乙两个容积相同且不变的密闭容器,向甲容器中加入1molN2和3molH2,在一定条件下达到平衡时放出热量为Q1KJ;在相同条件下,向乙容器中加入2molNH3达到平衡后吸收热量为Q2KJ,已知甲和乙两容器中所达到的平衡完全相同且Q1=4Q2。下列叙述不正确的是( )
2NH3(g),△H=-Q KJ/mol(Q>0)。有甲、乙两个容积相同且不变的密闭容器,向甲容器中加入1molN2和3molH2,在一定条件下达到平衡时放出热量为Q1KJ;在相同条件下,向乙容器中加入2molNH3达到平衡后吸收热量为Q2KJ,已知甲和乙两容器中所达到的平衡完全相同且Q1=4Q2。下列叙述不正确的是( )
| A.达平衡时,两容器中反应物的转化率不同,甲中N2和H2为80%,乙中NH3为20% |
| B.甲中NH3的体积分数与乙相等 |
| C.达到平衡后,再向乙中加入0.2moLN2、0.6molH2、1.6molNH3,平衡向生成NH3的方向移动 |
D.乙中的热化学反应方程式为2NH3(g) N2(g)+3H2(g);△H=+Q2KJ/mol N2(g)+3H2(g);△H=+Q2KJ/mol |
密闭容器发生下列反应aA(g)  cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
| A.A的转化率变大 | B.平衡向正反应方向移动 |
| C.D的体积分数变大 | D.a < c+d |
在一定条件下将1mol的CO和1mol H2O(g)放入密闭容器中发生反应:CO(g)+H2O(g)  CO2(g)+H2(g),达到平衡时测得CO2为0.6mol。再通入4mol H2O(g),达到新平衡后,CO2的物质的量为
CO2(g)+H2(g),达到平衡时测得CO2为0.6mol。再通入4mol H2O(g),达到新平衡后,CO2的物质的量为
| A.小于0.6mol大于0.4mol | B.等于1mol |
| C.大于0.6mol,小于1mol | D.大于1mol |
对某已经达到化学平衡状态的可逆反应,如果改变某种条件,使某反应物的浓度减小,则下列说法不正确的是
| A.平衡可能向正反应方向移动 | B.平衡可能向逆反应方向移动 |
| C.生成物的浓度相应增大 | D.平衡可能移动也可能不移动 |
在一定温度下,反应A2(g)+B2(g)  2AB(g)达到平衡的标志是
2AB(g)达到平衡的标志是
| A.单位时间内生成n mol A2,同时生成n mol AB |
| B.容器内总压强不随时间改变 |
| C.单位时间内生成2n mol AB同时生成n mol B2 |
| D.任何时间内A2、B2的物质的量之比为定值 |
在一定条件下,对于反应mA(g)+nB(g)  pC(g)+qD(g),C物质的质量分数[w(C)]与温度、压强的关系如图所示,下列判断正确的是( )
pC(g)+qD(g),C物质的质量分数[w(C)]与温度、压强的关系如图所示,下列判断正确的是( )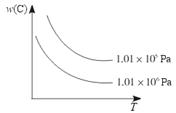
A.ΔH<0,m+n<p+q B.ΔH>0,m+n>p+q
C.ΔH>0,m+n<p+q D.ΔH<0,m+n>p+q
将1 mol CO和2 mol H2充入一容积为1L的密闭容器中,分别在250°C、T°C下发生反应:CO(g)+2H2(g)=CH3OH(g),ΔH="a" kJ/mol,如图。下列分析中正确的是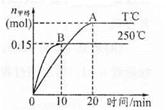
A.250°C时,0〜10minH2反应速率为 0.015 mol,/(L.min)
B.平衡时CO的转化率:T℃时小于250℃时
C.其他条件不变,若减小容积体积,CO体积分数增大
D.a<0,平衡常数K:T0C时大于2500C
某温度下,反应SO2(g)+ 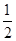 O2(g)
O2(g) SO3 (g) 的平衡常数K1=50,在同一温度下,反应SO3(g)
SO3 (g) 的平衡常数K1=50,在同一温度下,反应SO3(g) SO2(g) +
SO2(g) + 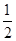 O2(g)的平衡常数K2的值为
O2(g)的平衡常数K2的值为
| A.2500 | B.100 | C.0.02 | D.0.001 |
汽车尾气净化中的一个反应如下:
 在恒容的密闭容器中,反应达到平衡后,改变某一条件,下列示意图正确的是
在恒容的密闭容器中,反应达到平衡后,改变某一条件,下列示意图正确的是
试题篮
()