mg铁与一定量水蒸气在高温条件下充分反应,测得生成氢气8.96L,将所得固体混合物完全溶解于足量盐酸,又放出氢气2.24L(气体体积均己折算为标况下),向所得溶液中滴加KSCN溶液,溶液颜色无明显变化。计算:
(1)铁与水蒸气反应时生成的氧化产物质量是多少?(2)最初所用铁粉的质量是多少?
200℃时CO2和水蒸气的混合气体共23.2g与足量的Na2O2充分反应后,固体质量增加了7.2g,则原混合气体的总物质的量为
| A.0.2mol | B.0.6mol | C.0.8mol | D.l.0mol |
实验室里常用浓盐酸与二氧化锰反应来制取少量的氯气,现取一定量的浓盐酸使其与二氧化锰发生反应,产生的氯气在标准状况下的体积为22.4 L。
请回答下列问题:
(1)写出该反应的离子反应方程式______________________。
(2)参加反应的二氧化锰的质量为____________。
(3)反应中被氧化的HCl的物质的量为 ____________。
a g CO 和H2的混合气体在足量O2中完全燃烧后,将产生的CO2和水蒸气通入过量的过氧化钠被其完全吸收,则过氧化钠固体增重的质量是
| A.a g | B.0.5a g | C.4.4a g | D.1.8a g |
设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A.常温常压下,7.8gNa2S固体和7.8gNa2O2固体中含有的阴离子数目均为0.1NA |
| B.在标准状况下,22.4LCl2和HCl的混合气体中含有的分子总数为2×6.02×1023 |
| C.含1molFeCl3的饱和溶液滴入沸水中得到胶体数目为NA |
| D.标准状况下,Na2O2与足量的CO2反应生成2.24LO2,转移电子数为0.4NA |
用98%的浓硫酸(密度为1.84g/ )配制100mL 1 mol/L的稀硫酸,现给出下列仪器(配制过程中可能用到):①100mL量筒 ②10mL量筒 ③50mL烧杯 ④托盘天平 ⑤100mL容量瓶 ⑥胶头滴管 ⑦玻璃棒,配制中使用仪器的先后顺序排列正确的是( )
)配制100mL 1 mol/L的稀硫酸,现给出下列仪器(配制过程中可能用到):①100mL量筒 ②10mL量筒 ③50mL烧杯 ④托盘天平 ⑤100mL容量瓶 ⑥胶头滴管 ⑦玻璃棒,配制中使用仪器的先后顺序排列正确的是( )
| A.④③⑦⑤⑥ | B.②⑤⑦⑥ | C.①③⑤⑥⑦ | D.②⑥③⑦⑤⑥ |
水泥是重要的建筑材料。水泥熟料的主要成分为 、 ,并含有一定量的铁、铝和镁等金属的氧化物。实验室测定水泥样品中钙含量的过程如图所示:
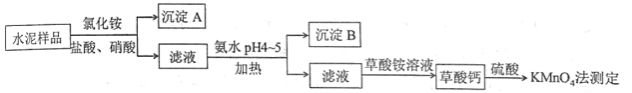
回答下列问题:
(1)在分解水泥样品过程中,以盐酸为溶剂,氯化铵为助溶剂,还需加入几滴硝酸。加入硝酸的目的是__________,还可使用___________代替硝酸。
(2)沉淀A的主要成分是_________________,其不溶于强酸但可与一种弱酸反应,该反应的化学方程式为____________________________________。
(3)加氨水过程中加热的目的是___________。沉淀B的主要成分为_____________、____________(写化学式)。
(4)草酸钙沉淀经稀 处理后,用 标准溶液滴定,通过测定草酸的量可间接获知钙的含 量,滴定反应为: 。实验中称取 水泥样品,滴定时消耗了 的 溶液 ,则该水泥样品中钙的质量分数为______________。
设NA为阿伏加德罗常数的值。下列说法正确的是
| A.71g氯气中氯原子数为 NA |
| B.标准状况下,22.4 LNH3所含的电子数为10NA |
| C.5.6g Fe在足量氯气中燃烧转移的电子数为2NA |
| D.标准状况下,11.2 L H2O中含有分子的数目为0.5NA |
设NA为阿伏加德罗常数的数值.下列说法正确的是
| A.1mol甲苯含有6NA个C﹣H键 |
| B.18g H2O含有10NA个质子 |
| C.标准状况下,22.4L氨水含有NA个NH3分子 |
| D.56g铁片投入足量浓H2SO4中生成NA个SO2分子 |
掌握仪器名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置:
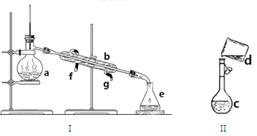
(1)写出下列仪器的名称:A. B. C.___________
(2)若利用装置I分离四氯化碳和酒精的混合物,还缺少的仪器是 ,将仪器补充完整后进行实验,温度计水银球的位置在 处。冷凝水的进出方向为 。
(3)现需配制0.1mol/LNaOH溶液450mL,装置II是某同学转移溶液的示意图。
①图中的错误是 。除了图中给出的的仪器和托盘天平外,为完成实验还需的仪器有: 。
②根据计算得知,所需NaOH的质量为 g
某实验小组设计实验测定Na2SO4和Na2CO3混合物中各组分的含量。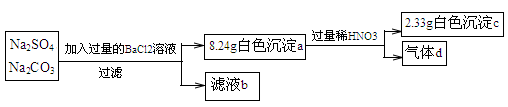
下列说法不正确的是
| A.沉淀a的主要成分是BaSO4和BaCO3 |
| B.滤液b中Na+的物质的量为0.08mol |
| C.气体d在标准状况下的体积为224mL |
| D.原混合物中Na2SO4与Na2CO3的物质的量之比为1:3 |
欲配制100ml 1.0 mol/LNa2SO4溶液,正确的方法是
① 将14.2 g Na2SO4 溶于100ml水中
② 将32.2g Na2SO4·10H2O溶于少量水中,再用水稀释至100 ml
③ 将20 ml 5.0 mol/L Na2SO4溶液用蒸馏水稀释至100 ml
| A.①② | B.②③ | C.①③ | D.①②③ |
实验室用氢氧化钠固体配980 m L0.1mol/ L的氢氧化钠溶液。
(1)配制过程的正确操作顺序(用①②③……表示)________________
①、计算所需固体氢氧化钠的质量________克;
②、将称取的固体氢氧化钠放在洁净的烧杯内,加约50─100 m L水,搅拌溶解并冷却至室温;
③、用天平称取所需量的固体氢氧化钠;
④、将溶液移入________中;
⑤、用蒸馏水洗涤烧杯内壁2─3次,将每次洗液全部移入容量瓶中,摇匀;
⑥、改用胶头滴管小心滴加蒸馏水至刻度线;
⑦、继续往容量瓶里加蒸馏水到液面接近刻度线1─2厘米处;
⑧、加盖瓶塞,反复摇匀;
(2)在上述步骤⑥时俯视,则所配置的溶液浓度会_________,若遗漏步骤⑤,则所配溶液浓度会______________。(填“偏高”、“偏低”或“不影响”)
试题篮
()