设NA表示阿伏加德罗常数的值,25℃,1.01×105 Pa时,64g SO2含有的分子数为
| A.2NA | B.NA | C.略小于NA | D.6.02×1022 |
用NA表示阿伏加德罗常数,下列叙述正确的是
| A.64g SO2含有氧原子数为1NA |
| B.物质的量浓度为0. 5mol/L Mg Cl2溶液,含有Cl-离子数为1NA |
| C.标准状况下,22.4L H2O的分子数为1NA |
| D.常温常压下,14g N2含有分子数为0.5NA |
用NA表示阿伏加德罗常数的值,下列说法正确的是
| A.常温常压下,5.6 L一氧化碳和5.6 L氧气混合后的分子总数为0.5NA |
| B.标准状况下,5.6 L N2和16.8L NO混合气体中的原子数为2NA |
| C.标准状况下,22.4L H2O中分子数为NA |
| D.常温常压下,1 mol氦气含有的原子数为2NA |
将13.7g Na2CO3和NaHCO3的混合物充分加热,共收集到标准状况下的气体1.12L,则混合物中Na2CO3和NaHCO3的物质的量之比为
| A.1︰1 | B.1︰2 | C.2︰1 | D.3︰1 |
下列叙述中,正确的是(NA代表阿伏加德罗常数)
| A.0.1 mol NH4+中,含有的质子数为NA |
| B.标准状况下,22.4 L水中含有的水分子数为NA |
| C.常温、常压下,22 g CO2中含有的氧原子数为NA |
| D.0.5 mol/L Na2SO4溶液中,含有的离子总数为1.5NA |
用NA表示阿伏加德罗常数的值.下列叙述正确的是
| A.常温常压下,33.6L氯气与27g铝充分反应,生成1molAlCl3 |
| B.1 mol SO2与足量O2在一定条件下反应生成SO3,共转移2NA个电子 |
| C.通常状况下,2.24LNO2和N2O4的混合气体中氮原子和氧原子数比为1:2 |
| D.1L 1mol/L的Na2CO3溶液中所含阴离子数等于NA个 |
NA表示阿伏加德罗常数,下列判断错误的是
| A.常温下,22 g CO2中含有NA个氧原子 |
| B.1 mol/L CaCl2溶液中Cl— 的数目等于2NA |
| C.标准状况下,33.6LCH4中含H原子数为6NA |
| D.1 mol Na 完全反应时,失去NA个电子 |
把由NaOH、AlCl3、MgCl2三种固体组成的混合物,溶于足量水中,有0.58g白色沉淀析出,向所得的浊液中,逐滴加入0.5mol/L的盐酸,加入盐酸的体积和生成沉淀的质量如图所示:

(1)混合物中NaOH的质量是 g,AlCl3的质量是 g。
(2)P点所表示盐酸加入体积为 mL。
水泥是重要的建筑材料。水泥熟料的主要成分为 、 ,并含有一定量的铁、铝和镁等金属的氧化物。实验室测定水泥样品中钙含量的过程如图所示:
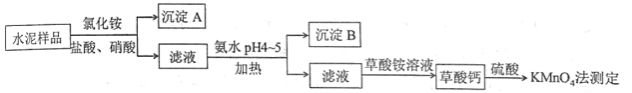
回答下列问题:
(1)在分解水泥样品过程中,以盐酸为溶剂,氯化铵为助溶剂,还需加入几滴硝酸。加入硝酸的目的是__________,还可使用___________代替硝酸。
(2)沉淀A的主要成分是_________________,其不溶于强酸但可与一种弱酸反应,该反应的化学方程式为____________________________________。
(3)加氨水过程中加热的目的是___________。沉淀B的主要成分为_____________、____________(写化学式)。
(4)草酸钙沉淀经稀 处理后,用 标准溶液滴定,通过测定草酸的量可间接获知钙的含 量,滴定反应为: 。实验中称取 水泥样品,滴定时消耗了 的 溶液 ,则该水泥样品中钙的质量分数为______________。
设NA为阿伏加德罗常数的值。下列说法正确的是
| A.71g氯气中氯原子数为 NA |
| B.标准状况下,22.4 LNH3所含的电子数为10NA |
| C.5.6g Fe在足量氯气中燃烧转移的电子数为2NA |
| D.标准状况下,11.2 L H2O中含有分子的数目为0.5NA |
设NA为阿伏加德罗常数的数值.下列说法正确的是
| A.1mol甲苯含有6NA个C﹣H键 |
| B.18g H2O含有10NA个质子 |
| C.标准状况下,22.4L氨水含有NA个NH3分子 |
| D.56g铁片投入足量浓H2SO4中生成NA个SO2分子 |
掌握仪器名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置:
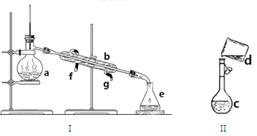
(1)写出下列仪器的名称:A. B. C.___________
(2)若利用装置I分离四氯化碳和酒精的混合物,还缺少的仪器是 ,将仪器补充完整后进行实验,温度计水银球的位置在 处。冷凝水的进出方向为 。
(3)现需配制0.1mol/LNaOH溶液450mL,装置II是某同学转移溶液的示意图。
①图中的错误是 。除了图中给出的的仪器和托盘天平外,为完成实验还需的仪器有: 。
②根据计算得知,所需NaOH的质量为 g
某实验小组设计实验测定Na2SO4和Na2CO3混合物中各组分的含量。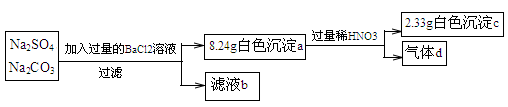
下列说法不正确的是
| A.沉淀a的主要成分是BaSO4和BaCO3 |
| B.滤液b中Na+的物质的量为0.08mol |
| C.气体d在标准状况下的体积为224mL |
| D.原混合物中Na2SO4与Na2CO3的物质的量之比为1:3 |
欲配制100ml 1.0 mol/LNa2SO4溶液,正确的方法是
① 将14.2 g Na2SO4 溶于100ml水中
② 将32.2g Na2SO4·10H2O溶于少量水中,再用水稀释至100 ml
③ 将20 ml 5.0 mol/L Na2SO4溶液用蒸馏水稀释至100 ml
| A.①② | B.②③ | C.①③ | D.①②③ |
实验室用氢氧化钠固体配980 m L0.1mol/ L的氢氧化钠溶液。
(1)配制过程的正确操作顺序(用①②③……表示)________________
①、计算所需固体氢氧化钠的质量________克;
②、将称取的固体氢氧化钠放在洁净的烧杯内,加约50─100 m L水,搅拌溶解并冷却至室温;
③、用天平称取所需量的固体氢氧化钠;
④、将溶液移入________中;
⑤、用蒸馏水洗涤烧杯内壁2─3次,将每次洗液全部移入容量瓶中,摇匀;
⑥、改用胶头滴管小心滴加蒸馏水至刻度线;
⑦、继续往容量瓶里加蒸馏水到液面接近刻度线1─2厘米处;
⑧、加盖瓶塞,反复摇匀;
(2)在上述步骤⑥时俯视,则所配置的溶液浓度会_________,若遗漏步骤⑤,则所配溶液浓度会______________。(填“偏高”、“偏低”或“不影响”)
试题篮
()