下列叙述中正确的是( )
| A.硫酸的摩尔质量是98g |
| B.铁原子的摩尔质量等于铁的相对原子质量 |
| C.标准状况下,22.4L的O2质量是32g |
| D.2gH2所含原子物质的量为1mol |
实验室需要配制240 mL 0.2 mol·L-1的Na2CO3溶液,回答下列问题:
(1)需称量Na2CO3·10H2O的质量 g。
(2)配制时各步骤操作如下,其正确的操作顺序是(用字母表示,每个字母只能用一次) 。
A.用30 mL水洗涤烧杯和玻璃棒2~3次,将洗涤液均注入容量瓶,振荡
B.用称取所需质量的Na2CO3·10H2O固体,放入烧杯中,再加入适量的蒸馏水,用玻璃棒慢慢搅动,使其完全溶解
C.将已冷却的溶液沿玻璃棒注入250 mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹液面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线1﹣2 cm处
(3)下列操作会使所配溶液浓度偏高的是 。
A.所选用的溶质已经变质,部分已失去了结晶水
B.转移前,容量瓶中含有少量蒸馏水
C.将未冷却的溶液沿玻璃棒注入容量瓶中
D.定容时,仰视刻度线
E.称量时误操作为“左码右物”
F.定容后使溶液混匀静止,发现凹液面低于刻度线,立即滴蒸馏水至刻度线
(4)取所配制的碳酸钠溶液125 mL,向其加入125 mL 0.3 mol·L-1的硫酸溶液,待充分反应后,生成的气体在标准状况下所占的体积为(假设产生的气体全部逸出)________mL;设反应后溶液的体积为250 mL,则反应后溶液中Na+的物质的量浓度为____________。
右图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。据此下列说法正确的是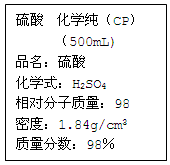
| A.该硫酸的物质的量浓度为9.2mol/L |
| B.1mol Zn与足量该硫酸反应产生2g氢气 |
| C.配制200mL 4.6mol/L的稀硫酸需取该硫酸50mL |
| D.该硫酸与等质量的水混合后所得溶液的浓度大于9.2mol/L |
Ⅰ.H2SO4的摩尔质量为 ;0.3mol的CO(NH2)2中含有 个电子(用NA表示);
Ⅱ.①标准状况下22.4 L CH4 ②1.5 mol NH3 ③1.806 x1024个H2O④标准状况下73g HCl所含H原子个数由多到少的顺序为 (填序号);在含0.4 mol Al2(SO4)3的溶液中SO42—的物质的量为 ;
Ⅲ.某常见气体在标准状况下的密度为1.25g/L,若该气体的分子式为A2型,则其名称是 ;该气体在一定条件下可与氢气反应生成氨气,试写出该反应的化学方程式 ;
Ⅳ.取100 mL a mol / L HCl溶液与300 mL n mol / L H2SO4溶液均注入到500 mL的容量瓶中,加水稀释到刻度线,则该混合溶液中H+ 的物质的量浓度为 mol / L;
设NA表示阿伏加德罗常数的值,25℃,1.01×105 Pa时,64g SO2含有的分子数为
| A.2NA | B.NA | C.略小于NA | D.6.02×1022 |
用NA表示阿伏加德罗常数的值,下列说法正确的是
| A.常温常压下,5.6 L一氧化碳和5.6 L氧气混合后的分子总数为0.5NA |
| B.标准状况下,5.6 L N2和16.8L NO混合气体中的原子数为2NA |
| C.标准状况下,22.4L H2O中分子数为NA |
| D.常温常压下,1 mol氦气含有的原子数为2NA |
下列叙述中,正确的是(NA代表阿伏加德罗常数)
| A.0.1 mol NH4+中,含有的质子数为NA |
| B.标准状况下,22.4 L水中含有的水分子数为NA |
| C.常温、常压下,22 g CO2中含有的氧原子数为NA |
| D.0.5 mol/L Na2SO4溶液中,含有的离子总数为1.5NA |
NA表示阿伏加德罗常数,下列判断错误的是
| A.常温下,22 g CO2中含有NA个氧原子 |
| B.1 mol/L CaCl2溶液中Cl— 的数目等于2NA |
| C.标准状况下,33.6LCH4中含H原子数为6NA |
| D.1 mol Na 完全反应时,失去NA个电子 |
把由NaOH、AlCl3、MgCl2三种固体组成的混合物,溶于足量水中,有0.58g白色沉淀析出,向所得的浊液中,逐滴加入0.5mol/L的盐酸,加入盐酸的体积和生成沉淀的质量如图所示:

(1)混合物中NaOH的质量是 g,AlCl3的质量是 g。
(2)P点所表示盐酸加入体积为 mL。
水泥是重要的建筑材料。水泥熟料的主要成分为 、 ,并含有一定量的铁、铝和镁等金属的氧化物。实验室测定水泥样品中钙含量的过程如图所示:
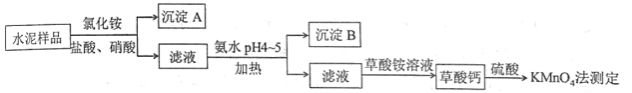
回答下列问题:
(1)在分解水泥样品过程中,以盐酸为溶剂,氯化铵为助溶剂,还需加入几滴硝酸。加入硝酸的目的是__________,还可使用___________代替硝酸。
(2)沉淀A的主要成分是_________________,其不溶于强酸但可与一种弱酸反应,该反应的化学方程式为____________________________________。
(3)加氨水过程中加热的目的是___________。沉淀B的主要成分为_____________、____________(写化学式)。
(4)草酸钙沉淀经稀 处理后,用 标准溶液滴定,通过测定草酸的量可间接获知钙的含 量,滴定反应为: 。实验中称取 水泥样品,滴定时消耗了 的 溶液 ,则该水泥样品中钙的质量分数为______________。
设NA为阿伏加德罗常数的值。下列说法正确的是
| A.71g氯气中氯原子数为 NA |
| B.标准状况下,22.4 LNH3所含的电子数为10NA |
| C.5.6g Fe在足量氯气中燃烧转移的电子数为2NA |
| D.标准状况下,11.2 L H2O中含有分子的数目为0.5NA |
设NA为阿伏加德罗常数的数值.下列说法正确的是
| A.1mol甲苯含有6NA个C﹣H键 |
| B.18g H2O含有10NA个质子 |
| C.标准状况下,22.4L氨水含有NA个NH3分子 |
| D.56g铁片投入足量浓H2SO4中生成NA个SO2分子 |
掌握仪器名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置:
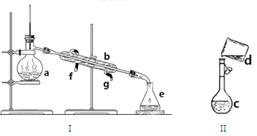
(1)写出下列仪器的名称:A. B. C.___________
(2)若利用装置I分离四氯化碳和酒精的混合物,还缺少的仪器是 ,将仪器补充完整后进行实验,温度计水银球的位置在 处。冷凝水的进出方向为 。
(3)现需配制0.1mol/LNaOH溶液450mL,装置II是某同学转移溶液的示意图。
①图中的错误是 。除了图中给出的的仪器和托盘天平外,为完成实验还需的仪器有: 。
②根据计算得知,所需NaOH的质量为 g
某实验小组设计实验测定Na2SO4和Na2CO3混合物中各组分的含量。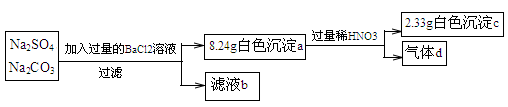
下列说法不正确的是
| A.沉淀a的主要成分是BaSO4和BaCO3 |
| B.滤液b中Na+的物质的量为0.08mol |
| C.气体d在标准状况下的体积为224mL |
| D.原混合物中Na2SO4与Na2CO3的物质的量之比为1:3 |
欲配制100ml 1.0 mol/LNa2SO4溶液,正确的方法是
① 将14.2 g Na2SO4 溶于100ml水中
② 将32.2g Na2SO4·10H2O溶于少量水中,再用水稀释至100 ml
③ 将20 ml 5.0 mol/L Na2SO4溶液用蒸馏水稀释至100 ml
| A.①② | B.②③ | C.①③ | D.①②③ |
试题篮
()