(7分)将标准状况下4.48 L的CO2通入适量的NaOH溶液中充分反应后,溶液中生成盐的质量为19.0 g。
(1)若要使生成的盐的质量变为25.2 g,则应继续向溶液中通入CO2多少克?(写出计算过程)
(2)向生成的19.0 g的盐溶液中加入一定量某物质,充分反应后,减压低温蒸发得到纯净的21.2 g Na2CO3固体。则:
①若只能加入0.05 mol某物质,则加入的物质可以是________或________。
②若只能加入0.10 mol某物质,则加入的物质可以是________或________。
常温下,在27.5g水中溶解12.5g CuSO4·5H2O,恰好达到饱和,该溶液密度为1.21g /cm3,求:
① 该溶液中阴阳离子的总物质的量 ② 该溶液中CuSO4的物质的量浓度
③ 取出20.0 ml该溶液,配成浓度为1.00 mol/L的稀溶液,则稀释后溶液的
积是多少毫升?。
(本题共14分)已知:硝酸铜受热易分解。
170℃时,2Cu (NO3)2 2CuO
2CuO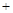 4NO2↑
4NO2↑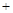 O2↑开始分解,至250℃分解完全。(其中2NO2
O2↑开始分解,至250℃分解完全。(其中2NO2 N2O4,2NO2
N2O4,2NO2 2NO
2NO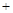 O2等反应忽略不计)。
O2等反应忽略不计)。
800℃时,4CuO 2Cu2O
2Cu2O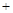 O2↑ 开始分解,至1000℃以上分解完全。
O2↑ 开始分解,至1000℃以上分解完全。
54.取5.64g无水硝酸铜,加热至1000℃以上,将生成的气体导入足量的NaOH溶液充分吸收后,还有逸出的气体是 (填分子式),体积(标准状况)为 ;将吸收液加水稀释到100mL,此溶液中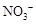 的物质的量浓度为 。
的物质的量浓度为 。
55.取5.64g无水硝酸铜加热至某温度分解后的残留固体中含有1.60g CuO,则残留固体的质量可能是 。
实验证明,当温度达到1800℃时,Cu2O也会发生分解:2Cu2O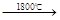 4Cu
4Cu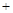 O2↑
O2↑
56.取8.00g CuO,加热到1800℃左右,冷却后称得质量为6.88g,通过计算求出反应后剩余固体中各成分的物质的量之比。
57.取8.00g CuO,通入一定量H2并加热,使其部分还原为Cu和Cu2O,且其中n (Cu2O) n (Cu)
n (Cu)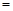 x。将此混合物溶于足量的稀硫酸中(Cu2O
x。将此混合物溶于足量的稀硫酸中(Cu2O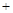 2H
2H
 Cu
Cu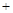 Cu
Cu
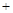 H2O),充分反应后过滤得到Cu y g,试求未被还原的CuO的物质的量(用含x、y的代数式表示)。
H2O),充分反应后过滤得到Cu y g,试求未被还原的CuO的物质的量(用含x、y的代数式表示)。
(6分)取50.0mL的碳酸钠和硫酸钠的混合溶液,加入过量氯化钡溶液后得到14.51g白色沉淀,用过量稀硝酸处理后沉淀量减少到4.66g,并有气体放出。试计算:
(1)原混合液中碳酸钠和硫酸钠的物质的量浓度。
(2)产生气体的质量
“铜都”安徽铜陵有许多黄铜矿(主要成分为CuFeS2,含少量Al2O3、SiO2),黄铜矿是制取铜及其化合物的主要原料之一,还可制备硫及铁的化合物。
(1)火法炼铜首先要焙烧黄铜矿,其反应原理为2CuFeS2+O2 Cu2S+2FeS+SO2。CuFeS2中Cu和Fe元素的化合价均为+2价,被还原的元素是 (填元素符号),若反应中转移0.3mol电子时,则标准状况下产生SO2的体积为 L。
Cu2S+2FeS+SO2。CuFeS2中Cu和Fe元素的化合价均为+2价,被还原的元素是 (填元素符号),若反应中转移0.3mol电子时,则标准状况下产生SO2的体积为 L。
(2)焙烧黄铜矿产生的Cu2S可被稀硝酸氧化为Cu2+ 和硫单质,HNO3的还原产物为NO,试写出Cu2S与稀硝酸反应的离子方程式 ,该反应中稀硝酸体现 (填“氧化性”、“还原性”或“酸性”)。
(3)焙烧黄铜矿还可得到Cu2O。将21.6g Cu2O加入到500mL某浓度的稀硝酸中,固体物质完全反应,生成Cu(NO3)2和NO,在所得溶液中加入1.0mol∙L-1的NaOH溶液1.0L,此时溶液呈中性。原硝酸的物质的量浓度为 。
(本题共14分)自然界中,金属硫化物矿床常因发生表生氧化及次生富集作用,产生辉铜矿(Cu2S)与铜蓝(CuS)。
已知:Cu2S、CuS是两种不溶于水的黑色固体,在一定条件下都能与稀HNO3反应:
①3CuS+8H++8NO3-→3Cu2++3SO42-+8NO↑+4H2O
②3Cu2S+16H++10NO3-→6Cu2++3SO42-+10NO↑+8H2O
现将四份质量不同的某Cu2S和CuS混合物样品分别与100mL 5mol/L的稀硝酸充分反应,样品质量与产生气体的体积(已折合成标准状况)如下表所示:
| 实验编号 |
甲 |
乙 |
丙 |
| 样品质量(g) |
9.6 |
12.8 |
64.0 |
| 气体体积(L) |
5.04 |
6.72 |
V |
试回答下列问题(不考虑硝酸的挥发以及溶液体积变化):
53.用质量分数为0.63、密度为1.42g/cm3的浓硝酸配置100mL、5mol/L的稀硝酸,需浓硝酸的体积为 。(保留1位小数)
54.甲实验结束后,溶液中c(NO3-) = 。
55.混合物样品中Cu2S、CuS的物质的量之比是多少?(写出计算过程)
56.乙实验结束后,溶液中氢离子的浓度是多少?(写出计算过程)
57.计算丙实验中产生气体的体积(V)。(写出计算过程)
绿矾(FeSO4·7H2O)硫酸法生产一种稀有金属产品过程中产出的副产品,产品外观为淡绿色或淡黄绿色结晶固体。加入适量可调节碱性水中的pH,与水中悬浮物有机结合,并加速沉淀,主要应用于水质净化和工业废水处理,同时具有杀菌作用。
(1)98% 1.84 g/cm3的浓硫酸在稀释过程中,密度下降,当稀释至50%时,密度为1.4g/cm3,50%的硫酸物质的量浓度为 (保留两位小数),50%的硫酸与30%的硫酸等体积混合,混合酸的浓度为 (填>、<、=")40%" 。
(2)实际生产用20%发烟硫酸(100克发烟硫酸含SO3 20克)配制稀硫酸,若用SO3·nH2O表示20%的发烟硫酸,则n=____________(保留两位小数)。
(3)绿矾在空气中容易被部分氧化为硫酸铁,现取7.32克晶体溶于稀盐酸后,加入足量的BaCl2溶液,过滤得沉淀9.32克;再通入112mL(标准状况)氯气恰好将Fe2+完全氧化,推测晶体的化学式为 。
(4)硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O](俗称莫尔盐),较绿矾稳定,在分析化学中常用来配制Fe2+的标准溶液,用此Fe2+的标准溶液可以测定剩余稀硝酸的量。现取8.64克Cu2S和CuS的混合物用200 mL 2 mol/L稀硝酸溶液处理,发生反应如下:
10NO3-+3Cu2S+16H+=6Cu2++10NO↑+3SO42-+8H2O
8NO3-+3CuS+8H+=3Cu2++3 SO42-+8NO↑+ 4H2O
剩余的稀硝酸恰好与V mL 2 mol/L (NH4)2Fe(SO4)2溶液完全反应。
已知:NO3-+3Fe2++4H+= NO↑+3Fe3++2H2O
① V值范围 ;
(本题共14分)
溴化钠是工业提溴的中间产物,也是重要的化工生产原料,回答下列问题。
56.工业上用氯气氧化卤水中的溴离子,吹出溴蒸气后用10% 的纯碱溶液吸收,反应的化学方程式为:
3Na2CO3+ 3Br2 → 5NaBr + NaBrO3 + 3CO2若生成标准状况下3.36 L CO2,吸收的Br2为________g。
57.吹出的溴蒸气中会含有少量未反应的氯气,用纯碱吸收后实际生成的是NaCl、NaBr和NaBrO3。若所得溶液中含0.1 mol NaCl与0.6 mol NaBr,则溶液中NaBrO3的物质的量为_______mol。
58.将纯碱吸收后所得的溶液浓缩,加入2 mol/L H2SO4后蒸馏可以回收纯溴:
5NaBr + NaBrO3 + 3H2SO4 → 3Na2SO4+ 3Br2↑+ 3H2O
已知向一定质量的浓缩液中加入300mL硫酸可回收81.6 g液溴,硫酸全部转化为硫酸钠。若改为加入180 mL硫酸,计算可回收的液溴的质量。
59.向0.3 mol NaBr固体中加入足量浓硫酸并微热,产生的气体呈红棕色,且残留物中不含溴元素。将所得气体通入280 mL 2 mol/L的Na2SO3溶液中,无任何气体逸出,最终得到只含NaBr、Na2SO4和NaHSO3三种溶质的无色溶液。求红棕色气体中各组分的化学式与物质的量。
把2.0 mol/L Fe2(SO4)3溶液和2.0 mol/L H2SO4等体积混合(假设混合后溶液的体积等于混合前溶液的体积之和)。计算:
(1)混合液中Fe3+的物质的量浓度 ;
(2)混合液中SO42—的物质的量浓度 ;
(3)向溶液中加入足量铁粉,经足够长时间后,铁粉有剩余,求此时溶液中FeSO4的物质的量浓度 。
铁是应用最广泛的金属,铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物。
(1)要确定铁的某氯化物FeClx的化学式,可用离子交换和滴定的方法。实验中称取0.54 g的FeClx样品,溶解后先进行阳离子交换预处理,再通过含有饱和OH-的阴离子交换柱,使Cl-和OH-发生交换。交换完成后,流出溶液的OH-用0.40 mol·L-1的盐酸滴定,滴至终点时消耗盐酸25.0 mL。计算该样品中氯的物质的量,并求出FeClx中x值:________(列出计算过程);
(2)现有一含有FeCl2和FeCl3的混合物样品;采用上述方法测得n(Fe)∶n(Cl)=1∶2.1,则该样品中FeCl3的物质的量分数为________。在实验中,FeCl2可用铁粉和________反应制备,FeCl3可用铁粉和________反应制备;
(3)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3与KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为________________;
将250mL密度1.31g/cm3、质量分数为15﹪的硫酸与适量的铁屑充分反应。计算:
(1)此硫酸溶液中H2SO4的物质的量浓度;
(2)生成的H2的体积(标况);
(3)将生成的FeSO4配成400mL溶液,此溶液中Fe2+的物质的量浓度
(本题共14分)中学化学中有许多与氮有关的反应。阅读材料,回答问题。
氨气和氧气在催化剂存在下的反应方程式为4NH3十5O2→4NO+6H2O完成下列计算:
①生成1molNO消耗氧气的体积为 L(标准状况)。
②5 mol NH3和5 molO2反应生成4 molNO,过量的氨溶于产物水中成为氨水,所得氨水的密度为0.75g/ml,则该氨水的物质的量浓度为_____mol/L。
③.如果没有催化剂,氨氧化生成NO的同时也生成氮气:4NH3十3O2→2N2+6H2O。若4 mol NH3和4 molO2恰好完全反应,则产物气体中NO的物质的量为_____ mol。
已知真空管中反应2NO2
 N2O4,现向一真空管中充入4L标况下的NO2气体:
N2O4,现向一真空管中充入4L标况下的NO2气体:
① 若在上述反应中有50% NO2的转化为N2O4,所得混合气的平均摩尔质量为______g/mol
若在上述反应中有50% NO2的转化为N2O4,所得混合气的平均摩尔质量为______g/mol (保留一位小数)。
(保留一位小数)。
② 将4LNO2通过真空管反应后,恢复到原状况,得到气体3L,其中NO2为_______L。
将4LNO2通过真空管反应后,恢复到原状况,得到气体3L,其中NO2为_______L。
各种氮氧化物(NO、NO2)是主要的大气污染物之一,治理氮氧化物(NOX)废气的方法之一是用NaOH溶液进行吸收,其反应原理可表示如下:
NO2+NO+2NaOH→2NaNO2+H2O 2NO2+2NaOH→ NaNO2+NaNO3+H2O
现有一NO与NO2的混合气体,将其通入50mL 2mol/L的NaOH溶液中,恰好完全吸收,测得溶液中含有NO3―0.02mol。
①所得溶液中NaNO2的物质的量为 mol;②混合气体中V(NO):V(NO2)= 。
(1)若要配制100mL0.1mo1·L-1Na2SO4溶液,需称量Na2SO4的质量为 g。
(2)将2240mL氨(标准状况)完全溶于水配成100mL溶液,氨水中NH3的物质的量浓度为 mol·L-1。(不考虑NH3与H2O的反应)
(3)实验室里常用固体氯化铵与足量熟石灰加热制取氨。若需要2240mL(标准状况)氨,求至少需要氯化铵的物质的量。
试题篮
()