(本题共14分)氨在工业生产中有广泛的用途。
54.某工厂平均每天产生约600 m3废氨水(该氨水浓度为153 mg/L,密度为1 g/cm3),该废氨水中氨的物质的量浓度为_____________。
55.若含0.800 mol NH3的某氨水溶液质量为54.0 g,向该溶液通入二氧化碳至反应完全,析出晶体后过滤,得到滤液31.2g,则NH4HCO3的产率为_______%。(保留1位小数)
56.NH3常用于制备NO。4NH3+5O2 →4NO+6H2O;(不考虑NO与氧气的反应),设空气中氧气的体积分数为0.20,氮气体积分数为0.80。为使NH3恰好完全氧化为NO,氨—空气混合物中氨的体积分数为________。
57.硫酸工业的尾气可以使用氨水进行吸收,既防止了有害物质的排放,也同时得到副产品氮肥。已知吸收尾气后的氨水全部转化为铵盐。取两份相同体积的铵盐溶液,一份中加入足量硫酸,产生0.09mol SO2(假设气体已全部逸出,下同);另一份中加入足量Ba(OH)2,产生0.16mol NH3,同时得到21.86g沉淀。通过计算,求铵盐溶液中各溶质成分与物质的量浓度之比。
(本题共14分)铜有多种化合物,氧化亚铜(Cu2O)、氯化亚铜(CuCl)、氯化铜(CuCl2)、CuSO4等。
完成下列计算:
(1)波尔多液是由硫酸铜、生石灰和水配制成的杀菌剂,不同情况下需要配制不同的比例。现配制按质量比CuSO4:CaO:H2O =1:2:200的波尔多液50Kg。
需要用CuSO4·5H2O g,CaO mol
(2)某工厂以精辉铜矿(主要成分为Cu2S)为原料冶炼金属铜,精辉铜矿中含23%杂质,日均产含Cu量97.5%的粗铜42t。
已知:总反应式 Cu2S+O2 2Cu+SO2
2Cu+SO2
日均需精辉铜矿 t,日均产SO2标准状况下体积 L
(3)印刷线路板的铜能被FeCl3的溶液腐蚀,将印刷线路板浸入200mL FeCl3溶液中,有11.2gCu被腐蚀掉。取出印刷线路板,向溶液中加入11.2g铁粉,充分反应溶液中还有4.8g不溶物。计算原FeCl3溶液的物质的量浓度。
(4)制备铜的某化合物晶体。取5.12g Cu、14.5mol/L HNO3 15 mL、6.0 mol/L HC1 50mL,混合后Cu完全反应,反应后溶液有中水54.32g,再经水浴保温蒸发掉42g水,冷却至20℃并过滤,得到8.12g晶体。通过计算推断此晶体的化学式 。
已知:20℃溶解度 CuC12·2H2O 73g /100g H2O Cu(NO3)2·3H2O 125g /100g H2O
硫有多种含氧酸,亚硫酸(H2SO3)、硫酸(H2SO4)、焦硫酸(H2SO4·SO3)、硫代硫酸(H2S2O3)等等,其中硫酸最为重要,在工业上有广泛的应用。在实验室,浓硫酸是常用的干燥剂。
完成下列计算:
(1)焦硫酸(H2SO4·SO3)溶于水,其中的SO3都转化为硫酸。若将445g焦硫酸溶于水配成4.00L硫酸,该硫酸的物质的量浓度为 。
(2)将1.95 g锌加入到12.00 mL 18.4 mol/L的浓硫酸中(假设生成的气体中无氢气,浓硫酸产生单一的还原产物),充分反应后,小心地将溶液稀释到1000 mL,取出15.00 mL,以酚酞为指示剂,用0.25 mol/L的NaOH溶液滴定,耗用NaOH溶液的体积为21.70 mL。通过计算确定浓硫酸被还原的产物是 。
(3)硫铁矿是工业上制硫酸的主要原料。硫铁矿氧化焙烧的化学反应如下:
3FeS2+8O2→Fe3O4+6SO2
4FeS2+11 O2→2Fe2O3+8SO2
若48mol FeS2完全反应耗用氧气2934.4L(标准状况),计算反应产物中Fe3O4与Fe2O3物质的量各为多少?
(4)闪锌矿(主要成份为ZnS)是含锌主要矿物之一,高温加热闪锌矿生成ZnO和SO2。ZnO用于冶炼金属锌,SO2可制亚硫酸盐或硫酸。计算回答下列问题(计算保留2位小数)
取1.56 g闪锌矿样品,在空气中高温加热(杂质不反应),充分反应后,冷却,得到残留固体的质量为1.32 g,样品中含硫化锌的质量分数是多少?
生产10吨98%的浓硫酸需要这种矿石多少吨?(反应过程中硫损失2%)
硫有多种含氧酸,亚硫酸(H2SO3)、硫酸(H2SO4)、焦硫酸、硫代硫酸(H2S2O3)等,其中硫酸最为重要,在工业上有广泛的应用。
完成下列计算:
(1)浓硫酸与铜在加热时发生反应,生成二氧化硫气体的体积为4.48L(标准状况),若将反应后的溶液稀释至500mL,该溶液中硫酸铜的物质的量浓度为 mol·L-1;
(2)焦硫酸(H2SO4·SO3)溶于水,其中的SO3都转化为硫酸,若将445g焦硫酸溶于水配成4.00L硫酸,该硫酸的物质的量浓度为 mol·L-1。
将250mL密度1.31g/cm3、质量分数为15﹪的硫酸与适量的铁屑充分反应。计算:
(1)此硫酸溶液中H2SO4的物质的量浓度;
(2)生成的H2的体积(标况);
(3)将生成的FeSO4配成400mL溶液,此溶液中Fe2+的物质的量浓度
(本题共14分)已知:硝酸铜受热易分解。
170℃时,2Cu (NO3)2 2CuO
2CuO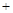 4NO2↑
4NO2↑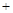 O2↑开始分解,至250℃分解完全。(其中2NO2
O2↑开始分解,至250℃分解完全。(其中2NO2 N2O4,2NO2
N2O4,2NO2 2NO
2NO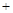 O2等反应忽略不计)。
O2等反应忽略不计)。
800℃时,4CuO 2Cu2O
2Cu2O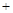 O2↑ 开始分解,至1000℃以上分解完全。
O2↑ 开始分解,至1000℃以上分解完全。
54.取5.64g无水硝酸铜,加热至1000℃以上,将生成的气体导入足量的NaOH溶液充分吸收后,还有逸出的气体是 (填分子式),体积(标准状况)为 ;将吸收液加水稀释到100mL,此溶液中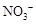 的物质的量浓度为 。
的物质的量浓度为 。
55.取5.64g无水硝酸铜加热至某温度分解后的残留固体中含有1.60g CuO,则残留固体的质量可能是 。
实验证明,当温度达到1800℃时,Cu2O也会发生分解:2Cu2O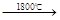 4Cu
4Cu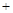 O2↑
O2↑
56.取8.00g CuO,加热到1800℃左右,冷却后称得质量为6.88g,通过计算求出反应后剩余固体中各成分的物质的量之比。
57.取8.00g CuO,通入一定量H2并加热,使其部分还原为Cu和Cu2O,且其中n (Cu2O) n (Cu)
n (Cu)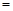 x。将此混合物溶于足量的稀硫酸中(Cu2O
x。将此混合物溶于足量的稀硫酸中(Cu2O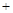 2H
2H
 Cu
Cu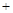 Cu
Cu
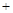 H2O),充分反应后过滤得到Cu y g,试求未被还原的CuO的物质的量(用含x、y的代数式表示)。
H2O),充分反应后过滤得到Cu y g,试求未被还原的CuO的物质的量(用含x、y的代数式表示)。
把2.0 mol/L Fe2(SO4)3溶液和2.0 mol/L H2SO4等体积混合(假设混合后溶液的体积等于混合前溶液的体积之和)。计算:
(1)混合液中Fe3+的物质的量浓度 ;
(2)混合液中SO42—的物质的量浓度 ;
(3)向溶液中加入足量铁粉,经足够长时间后,铁粉有剩余,求此时溶液中FeSO4的物质的量浓度 。
(1)若要配制100mL0.1mo1·L-1Na2SO4溶液,需称量Na2SO4的质量为 g。
(2)将2240mL氨(标准状况)完全溶于水配成100mL溶液,氨水中NH3的物质的量浓度为 mol·L-1。(不考虑NH3与H2O的反应)
(3)实验室里常用固体氯化铵与足量熟石灰加热制取氨。若需要2240mL(标准状况)氨,求至少需要氯化铵的物质的量。
铁是应用最广泛的金属,铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物。
(1)要确定铁的某氯化物FeClx的化学式,可用离子交换和滴定的方法。实验中称取0.54 g的FeClx样品,溶解后先进行阳离子交换预处理,再通过含有饱和OH-的阴离子交换柱,使Cl-和OH-发生交换。交换完成后,流出溶液的OH-用0.40 mol·L-1的盐酸滴定,滴至终点时消耗盐酸25.0 mL。计算该样品中氯的物质的量,并求出FeClx中x值:________(列出计算过程);
(2)现有一含有FeCl2和FeCl3的混合物样品;采用上述方法测得n(Fe)∶n(Cl)=1∶2.1,则该样品中FeCl3的物质的量分数为________。在实验中,FeCl2可用铁粉和________反应制备,FeCl3可用铁粉和________反应制备;
(3)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3与KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为________________;
向某AgNO3溶液中,逐滴加入密度为1.10g/mL的盐酸,恰好完全反应时,过滤所得沉淀的质量恰好与盐酸的质量相等。求盐酸的质量分数和物质的量浓度。(要求有简单计算过程)
将BaCl2·xH2O的晶体2.44克溶于水配成100mL溶液,取此溶液25mL与50mL0.1mol/L的AgNO3溶液作用,刚好把Cl-离子沉淀完全。①求2.44克的BaCl2·xH2O的物质的量。
②求BaCl2·xH2O的摩尔质量。③求BaCl2·xH2O的晶体的x的值。
取1.43g Na2CO3·10H2O溶于水配成100ml溶液,求:
(1)Na2CO3物质的量浓度;
(2)Na+物质的量浓度;
(3)取出20ml该溶液用蒸馏水稀释,使Na2CO3溶液物质的量浓度变为0.04mol/L,求加入蒸馏水的体积(设稀释时,对溶液体积的影响忽略不计)。
现有物质的量浓度为12.0mol/L的浓盐酸.
(1)配制100mL3.0mol/L的盐酸,需以上浓盐酸多少mL?
(2)假设浓盐酸的密度为1.2g/cm3,则其溶质的质量分数是多少?
在标准状况下,将224L氯化氢气体溶于635mL的水(密度为1g/cm3)中,所得盐酸的密度为1.18g/cm3(没有计算过程,只有答案不给分。)
(1)该盐酸中溶质的质量分数是多少?
(2)该盐酸的物质的量浓度为多少?
(3)取这种盐酸10mL,稀释到1.45L,所得稀盐酸的物质的量浓度是多少?
过氧化钙是一种安全无毒的物质,带有数量不等的结晶水,通常还含有部分CaO。
(1)称取0.542g过氧化钙样品,灼热时发生如下反应: 2CaO2·XH2O  2CaO + O2↑ + 2XH2O,得到的O2在标准状况下体积为67.2mL,该样品中CaO2的物质的量为 。
2CaO + O2↑ + 2XH2O,得到的O2在标准状况下体积为67.2mL,该样品中CaO2的物质的量为 。
(2)另取同一样品0.542g,溶于适量的稀盐酸中,然后加入足量的Na2CO3溶液,将溶液中Ca2+全部转化为CaCO3沉淀,得到干燥的CaCO3 0.70g。
① 试计算样品中CaO的质量。
② 试计算样品中CaO2·XH2O的X值。
试题篮
()