某同学称取了4.0 g NaOH固体,欲配制100 mL溶液。回答下列问题:
(1)该实验中,用到的能确定体积的两种玻璃仪器是 、 。
(2)操作过程中多次用到玻璃棒,其在实验中的作用有 。
(3)分析下列操作对实验结果的影响(填“偏大”“偏小”或“不变”):
①在溶解过程中有少量液体溅出烧杯外 ;
②定容时仰视仪器上的刻度线 ;
③定容后,将容量瓶振荡摇匀后,静置发现液面低于刻度线,于是又加入少量水至刻度线 。
(4)最后所得的溶液应存放在试剂瓶中,并贴上标签,请你填写该标签(如下图)。

用18.4 mol·L-1的浓H2SO4配制100mL浓度为1 mol·L-1的稀H2SO4,其操作可分为以下各步:
| A.用量筒量取5.4ml浓H2SO4缓缓注入装有约50mL蒸馏水的烧杯中,并用玻璃棒搅拌; |
| B.用约30mL蒸馏水,分成3次洗涤烧杯和玻棒,将每次洗涤液都注入容量瓶中; |
| C.将稀释后的H2SO4小心转移到100mL容量瓶里; |
| D.检查100mL容量瓶口部是否会发生滴漏; |
E.用量筒加蒸馏水至容量瓶中液面接近刻度2cm处;
F.盖紧瓶塞,反复颠倒振荡,摇匀溶液;
G.用胶头滴管向容量瓶里逐滴滴加蒸馏水至液面最低点和刻度线相平,试填空
①正确的操作顺序为(用字母填写)___________________。
②进行A步操作时,应选择下列量器______________(填序号)。
a.10ml量筒 b.50ml量筒 c.100ml量筒
如果对装有浓H2SO4的量筒读数如图所示,配制的稀H2SO4的浓度将_______________(偏高、偏低、无影响)

③进入A步操作后,必须___________________后才能进行C操作。
根据下图中A、B两种固体物质的溶解度曲线,回答下列问题:
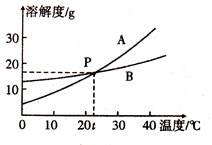
(1)10oC时,将10gB溶于100g水中,形成溶液的质量是 ,将它变成饱和溶液可采用的一种方法是 。
(2)P点的含义是 。在30oC时,A、B两物质饱和溶液的溶质质量分数的大小关系为A B(填“>”“<”或“=”)。当A中含有少量B 时,提纯A所采用的方法为 。
将25℃、101KPa条件下的氯化氢(HCl)气体49.6L,通入127mL水中(已知水的密度为:1.00g/mL),得到密度为1.19g/mL的盐酸(即氯化氢的水溶液)。(注:25℃、101KPa条件下气体摩尔体积为24.8L/mol。)
(1)此盐酸的溶质的质量分数为 ;
(2)此盐酸的溶质的物质的量浓度为 mol/L;
(3)取出20.0 mL该溶液,配成浓度为1.00 mol/L的稀溶液,则稀释后溶液的体积是 mL;
(4)0.100 mol/L的稀盐酸500mL中含有的氯离子的数目为 。
如图所示为中学化学实验中几种常见仪器的部分结构:

(1)请写出上述仪器的名称:
A ;B ;C 。
(2)若要配制一定物质的量浓度的硫酸溶液,必须使用上述仪器中的 (填字母)。
(3)上述仪器在使用之前必须检查是否漏水的是 (填字母),检查该仪器是否漏水的具体操作方法是 。
实验室里常用浓盐酸与二氧化锰反应来制取少量的氯气,现取一定量的浓盐酸使其与二氧化锰发生反应,产生的氯气在标准状况下的体积为22.4 L。
请回答下列问题:
(1)写出该反应的离子反应方程式______________________。
(2)参加反应的二氧化锰的质量为____________。
(3)反应中被氧化的HCl的物质的量为 ____________。
目前,我国采用“接触法”制硫酸,设备如图所示:
(1)图中设备A的名称是______________,该设备中主要反应的化学方程式为____________。
(2)有关接触法制硫酸的下列说法中,不正确的是______________________
| A.二氧化硫的接触氧化在接触室中发生 |
| B.吸收塔用浓度为98.3%浓硫酸吸收三氧化硫 |
| C.B装置中反应的条件之一为较高温度是为了提高SO2的转化率 |
| D.硫酸工业中在接触室安装热交换器是为了利用SO3转化为H2SO4时放出的热量 |
(3)用18 mol/L 的浓硫酸配制100 mL 3.6 mol/L 稀硫酸,所需浓硫酸的体积是_______。
(1)M(NO3)2的热分解化学方程式为:2M(NO3)2 2MO+4NO2↑+O2↑,加热29.6g M(NO3)2使其完全分解,在标准状况下收集2.24L的O2,则M的摩尔质量是
2MO+4NO2↑+O2↑,加热29.6g M(NO3)2使其完全分解,在标准状况下收集2.24L的O2,则M的摩尔质量是
(2)同温同压,等质量的O2和SO2,它们的物质的量之比为_________,密度之比为___________。
(3)标准状况下,3.4g NH3的体积为 L;它与标准状况下 L H2S含有相同数目的氢原子。
(1)MgCl2的摩尔质量是 ;0.1mol CO2在标准状况下体积约是 ;0.2 mol·L-1的Cu(NO3)2溶液中NO3-的物质的量浓度是 。
(2)现有以下物质:①熔融NaCl ②液氨 ③醋酸水溶液 ④HCl气体 ⑤酒精(C2H5OH)。请用相应序号填空:能导电的是 ;属于电解质的是 。
(3)CH3COOH的电离方程式为 。
按要求填空:
(1)除去下列物质中所混有的少量杂质,写出有关的反应方程式。
①Fe2O3中混有少量SiO2 ;
② NO中混有NO2 。
(2)为什么不能用加热NH4Cl固体的方式制取氨气(用化学方程式表示): 。
(3)将1.92g Cu投入到100mL某浓度的硝酸溶液中,观察到产生红棕色气体,随着反应的进行,气体颜色逐渐变浅。铜完全反应完后,共收集到1.12L气体(标准状况下测定),则此时参与反应且未被还原的硝酸物质的量为 ;所产生的气体中NO2的体积分数为 。
Ⅰ.H2SO4的摩尔质量为 ;0.3mol的CO(NH2)2中含有 个电子(用NA表示);
Ⅱ.①标准状况下22.4 L CH4 ②1.5 mol NH3 ③1.806 x1024个H2O④标准状况下73g HCl所含H原子个数由多到少的顺序为 (填序号);在含0.4 mol Al2(SO4)3的溶液中SO42—的物质的量为 ;
Ⅲ.某常见气体在标准状况下的密度为1.25g/L,若该气体的分子式为A2型,则其名称是 ;该气体在一定条件下可与氢气反应生成氨气,试写出该反应的化学方程式 ;
Ⅳ.取100 mL a mol / L HCl溶液与300 mL n mol / L H2SO4溶液均注入到500 mL的容量瓶中,加水稀释到刻度线,则该混合溶液中H+ 的物质的量浓度为 mol / L;
(1)在NaOH溶液中通入一定量的CO2后,溶液中溶质的组成可能是
①________ ,②________ ,③________ ,④_______ _。
(2)现有甲、乙两瓶无色溶液,已知它们可能为AlCl3溶液和NaOH溶液。现分别将一定体积的甲、乙两溶液混合,具体情况如下表所示,请回答:
| |
实验① |
实验② |
实验③ |
| 取甲瓶溶液的量 |
400 mL |
120 mL |
120 mL |
| 取乙瓶溶液的量 |
120 mL |
440 mL |
400 mL |
| 生成沉淀的量 |
1.56 g |
1.56 g |
3.12 g |
①甲瓶溶液为_______ _ 溶液。
②乙瓶溶液为________ 溶液,其物质的量浓度为________mol·L-1。
(1)同温同压下,同体积的CO2和CO,它们的质量之比为 ,密度之比为 。
(2)在50 mL 1 mol·L-1 FeCl3溶液中,加入100 mL NaOH溶液恰好完全反应,则该NaOH溶液的浓度为 。
(3)标准状况下的HCl气体4.48L溶于水形成100mL溶液,所得盐酸的物质的量浓度为_____________;
将此溶液与足量的铁屑充分反应,生成的H2在标准状况下的体积为________________。
实验室需要90mL 2.0 mol·L-1的Na2CO3溶液,现用无水碳酸钠粉未配制;请回答下列问题:
(1)请先通过计算,再确定称取 g无水碳酸钠。
(2)下列仪器中,不会用到的是
A.50mL容量瓶; B.100mL容量瓶; C.玻棒;
D.100mL量筒; E.托盘天平; F.药匙
(3)若要实施配制,除上述仪器外,尚缺的仪器是 。
(4)容量瓶在使用前必须进行的操作是 。
(5)配制过程简述为以下各步:其正确的操作顺序为 (填各步骤序号)。
A.冷却至室温; B.洗涤并移液; C.称取; D.溶解;
E.摇匀装瓶; F.定容; G.移液
(6)在配制过程中,下列情况对浓度有何影响?
① 容量瓶用蒸馏水洗净后,没等到干燥,就移入溶液定容,则所配溶液的浓度
(填“偏高”或“偏低”或“无影响”,下同);
② 转移溶液时,不小心有溶液溅在瓶外,则所配溶液的浓度
③定容时若俯视刻度线,则所配溶液的浓度
④若在滴加蒸馏水时,不慎超过了刻度线,则所配溶液的浓度 。
此时应如何处理? 。
实验室要配制100 mL 0.5 mol·L-1的NaCI溶液,试回答下列问题:
(1)下列仪器中,肯定不会用到的是
A.锥形瓶
B.烧瓶
C.量筒
D.胶头滴管
E.100 mL容量瓶
F.天平
(2)若要进行配制,除(1)中所列仪器外,还缺少的玻璃仪器是 。
(3)容量瓶在使用前必须进行的一步操作是 。
(4)配制完毕后,教师指出有四位同学各进行了下列某一项错误操作,你认为这四项错误操作会导致所得溶液浓度偏低的是
A.定容时仰视容量瓶刻度线
B.定容时俯视容量瓶刻度线
C.将溶解冷却后的溶液转人容量瓶后就进行定容操作
D.定容后把容量瓶倒置摇匀后发现液面低于刻度线,便补充几滴水至刻度处
试题篮
()