19.2gSO2在标准状况下的体积为________L,其中含氧原子的物质的量为________mol,该气体在标准状况下的密度是________。
(Ⅰ). 某溶液可能含有Cl-、SO42-、CO32-、NH4+、Fe3+、Al3+和K+。取该溶液100mL,加入过量NaOH溶液,加热,得到0.02mol气体,同时产生红褐色沉淀;过滤,洗涤,灼烧,得到1.6g固体;向上述滤液中加足量BaCl2溶液,得到4.66g不溶于盐酸的沉淀。(已知Al(OH)3可被NaOH溶液溶解)由此可知原溶液中:
(1)至少存在 种离子
(2)Cl- 是 存在(填“一定”“一定不”“可能”),c(Cl‑)范围是 mol/L(若存在Cl- 则计算并填写,若不存在或可能存在Cl-,则此空不填)
(3)写出产生红褐色沉淀的离子方程式:
(Ⅱ).实验室要用98%(ρ="1.84" g·cm-3)的硫酸配制3.68 mol·L-1的硫酸溶液500mL
(1)计算所需98%的硫酸 mL。
(2)要配制3.68mol·L-1的硫酸溶液500mL,准确量取一定体积的98%的硫酸后,还需用到的实验仪器是(填写序号): .
①量筒 ②烧杯 ③1000mL容量瓶 ④500mL 容量瓶 ⑤天平 ⑥胶头滴管 ⑦锥形瓶 ⑧玻璃棒
(3)若配制3.68mol·L-1的硫酸溶液的其他操作均正确,但出现下列错误操作,将例所配制的硫酸溶液浓度偏低的是 。
| A.浓硫酸溶解后未冷却,直接转移至容量瓶后定容 |
| B.将烧杯内的稀硫酸向容量瓶中转移时,因操作不当使部分稀硫酸溅出瓶外。 |
| C.用量筒量取浓硫酸时,俯视读数 |
| D.容量瓶使用前用含硫酸的溶液润洗了 |
(1)17克NH3共有 mol原子,0.1molH2S共有 个氢原子;在标准状况下,71g氯气的体积是 L,将其与氢气完全化合,需氢气的物质的量是 mol。
根据下图中A、B两种固体物质的溶解度曲线,回答下列问题:
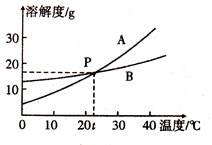
(1)10oC时,将10gB溶于100g水中,形成溶液的质量是 ,将它变成饱和溶液可采用的一种方法是 。
(2)P点的含义是 。在30oC时,A、B两物质饱和溶液的溶质质量分数的大小关系为A B(填“>”“<”或“=”)。当A中含有少量B 时,提纯A所采用的方法为 。
以下几种物质:
①3.0 g H2 ②1.5molHCl气体 ③2mol氩气, 请回答:
(1)含有分子数最多的是___________ _ (填序号,下同);
(2)标准状况下体积最大是 。
(3)同温同压下密度最小的是 。
人在虚脱后需迅速补充葡萄糖。下图是医院给病人输液时用的一瓶质量分数为5%的葡萄糖(C6H12O6)注射液标签,请认真观察标签上所列的内容后填写:
(1)该溶液的密度为________ g/mL;
(2)该溶液的物质的量浓度为________ mol/L(精确到小数点后面两
位)。
(1)MgCl2的摩尔质量是 ;0.1mol CO2在标准状况下体积约是 ;0.2 mol·L-1的Cu(NO3)2溶液中NO3-的物质的量浓度是 。
(2)现有以下物质:①熔融NaCl ②液氨 ③醋酸水溶液 ④HCl气体 ⑤酒精(C2H5OH)。请用相应序号填空:能导电的是 ;属于电解质的是 。
(3)CH3COOH的电离方程式为 。
按要求填空:
(1)除去下列物质中所混有的少量杂质,写出有关的反应方程式。
①Fe2O3中混有少量SiO2 ;
② NO中混有NO2 。
(2)为什么不能用加热NH4Cl固体的方式制取氨气(用化学方程式表示): 。
(3)将1.92g Cu投入到100mL某浓度的硝酸溶液中,观察到产生红棕色气体,随着反应的进行,气体颜色逐渐变浅。铜完全反应完后,共收集到1.12L气体(标准状况下测定),则此时参与反应且未被还原的硝酸物质的量为 ;所产生的气体中NO2的体积分数为 。
Ⅰ.H2SO4的摩尔质量为 ;0.3mol的CO(NH2)2中含有 个电子(用NA表示);
Ⅱ.①标准状况下22.4 L CH4 ②1.5 mol NH3 ③1.806 x1024个H2O④标准状况下73g HCl所含H原子个数由多到少的顺序为 (填序号);在含0.4 mol Al2(SO4)3的溶液中SO42—的物质的量为 ;
Ⅲ.某常见气体在标准状况下的密度为1.25g/L,若该气体的分子式为A2型,则其名称是 ;该气体在一定条件下可与氢气反应生成氨气,试写出该反应的化学方程式 ;
Ⅳ.取100 mL a mol / L HCl溶液与300 mL n mol / L H2SO4溶液均注入到500 mL的容量瓶中,加水稀释到刻度线,则该混合溶液中H+ 的物质的量浓度为 mol / L;
(1)在NaOH溶液中通入一定量的CO2后,溶液中溶质的组成可能是
①________ ,②________ ,③________ ,④_______ _。
(2)现有甲、乙两瓶无色溶液,已知它们可能为AlCl3溶液和NaOH溶液。现分别将一定体积的甲、乙两溶液混合,具体情况如下表所示,请回答:
| |
实验① |
实验② |
实验③ |
| 取甲瓶溶液的量 |
400 mL |
120 mL |
120 mL |
| 取乙瓶溶液的量 |
120 mL |
440 mL |
400 mL |
| 生成沉淀的量 |
1.56 g |
1.56 g |
3.12 g |
①甲瓶溶液为_______ _ 溶液。
②乙瓶溶液为________ 溶液,其物质的量浓度为________mol·L-1。
(1)同温同压下,同体积的CO2和CO,它们的质量之比为 ,密度之比为 。
(2)在50 mL 1 mol·L-1 FeCl3溶液中,加入100 mL NaOH溶液恰好完全反应,则该NaOH溶液的浓度为 。
(3)标准状况下的HCl气体4.48L溶于水形成100mL溶液,所得盐酸的物质的量浓度为_____________;
将此溶液与足量的铁屑充分反应,生成的H2在标准状况下的体积为________________。
实验室需要90mL 2.0 mol·L-1的Na2CO3溶液,现用无水碳酸钠粉未配制;请回答下列问题:
(1)请先通过计算,再确定称取 g无水碳酸钠。
(2)下列仪器中,不会用到的是
A.50mL容量瓶; B.100mL容量瓶; C.玻棒;
D.100mL量筒; E.托盘天平; F.药匙
(3)若要实施配制,除上述仪器外,尚缺的仪器是 。
(4)容量瓶在使用前必须进行的操作是 。
(5)配制过程简述为以下各步:其正确的操作顺序为 (填各步骤序号)。
A.冷却至室温; B.洗涤并移液; C.称取; D.溶解;
E.摇匀装瓶; F.定容; G.移液
(6)在配制过程中,下列情况对浓度有何影响?
① 容量瓶用蒸馏水洗净后,没等到干燥,就移入溶液定容,则所配溶液的浓度
(填“偏高”或“偏低”或“无影响”,下同);
② 转移溶液时,不小心有溶液溅在瓶外,则所配溶液的浓度
③定容时若俯视刻度线,则所配溶液的浓度
④若在滴加蒸馏水时,不慎超过了刻度线,则所配溶液的浓度 。
此时应如何处理? 。
实验室要配制100 mL 0.5 mol·L-1的NaCI溶液,试回答下列问题:
(1)下列仪器中,肯定不会用到的是
A.锥形瓶
B.烧瓶
C.量筒
D.胶头滴管
E.100 mL容量瓶
F.天平
(2)若要进行配制,除(1)中所列仪器外,还缺少的玻璃仪器是 。
(3)容量瓶在使用前必须进行的一步操作是 。
(4)配制完毕后,教师指出有四位同学各进行了下列某一项错误操作,你认为这四项错误操作会导致所得溶液浓度偏低的是
A.定容时仰视容量瓶刻度线
B.定容时俯视容量瓶刻度线
C.将溶解冷却后的溶液转人容量瓶后就进行定容操作
D.定容后把容量瓶倒置摇匀后发现液面低于刻度线,便补充几滴水至刻度处
(本小题满分5分)完成下列各小题
(1)能与碱反应生成盐和水的氧化物叫做酸性氧化物,能与酸反应生成盐和水的氧化物叫做碱性氧化物。下列氧化物中属于酸性氧化物的有 ;属于碱性氧化物的有 ;
①Na2O ②CO ③CO2 ④Al2O3 ⑤SO2 ⑥CuO ⑦P2O5。
(2)100mL0.25mol·L-1BaCl2溶液中,Cl-物质的量浓度为 ,若将上述溶液中的Ba2+恰好完全沉淀,需要物质的量浓度为1.00mol·L-1的稀硫酸 mL。
(3)标准状况下,等质量的下列气体所占有的体积最大的是 。
①O2 ②CH4 ③CO2 ④SO2
(10分)
(1)6.02×1023个CO2与 molH2质量相等,与 gSO2含有的原子个数相等;
(2)含0.4molCl的氯化镁是 mol,质量是 g,它跟 g氯化钠含有相同数目的Cl;
(3)4molNa2CO3与 molNa2SO4所含氧原子数相等;
(4)8g的甲烷是 mol,约含 个甲烷分子, g碳元素, mol氢原子。
试题篮
()