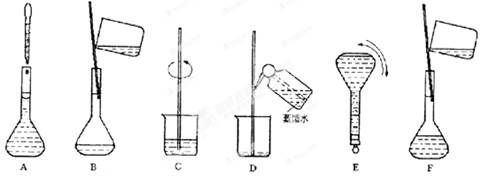
下图为两套实验装置。
(1)写出下列仪器的名称:


① ;② 。
(2)仪器①~④中,使用时必须检查是否漏水的有 。(填序号)
(3)若利用装置I制取蒸馏水,还缺少的仪器是 ,将仪器补充完整后进行的实验操作的名称为: ,冷却水从 口进。
(4)某学生欲用11.9 mol/L浓盐酸和蒸馏水配制480mL物质的量浓度为0.400 mol/L的稀盐酸.
①其中装置II是某同学配制此溶液时转移操作的示意图,图中有两处错误分别是 、 。
②将下列操作填写完整,并排列其正确的操作顺序(字母表示,每个字母只用一次)_ _ _ _;
| A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡 |
| B.用量筒准确量取浓盐酸_________ mL,注入烧杯中,加入少量水(约30mL),用玻璃棒慢慢搅拌,使其混合均匀 |
| C.将已冷却的盐酸沿玻璃杯注入_________ 中 |
| D.将容量瓶盖紧,颠倒摇匀 |
E.改用_________ 加水,使溶液凹液面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度线_________ 处.
③若配制时,因加水不慎略超过了容量瓶刻度线,此时实验应如何继续进行?________
④在配制过程中,如果其他操作都是正确的,下列操作会引起浓度偏高的是__________。
a没有洗涤烧杯和玻璃棒
b转移溶液时不慎有少量溶液洒到容量瓶外面
c容量瓶不干燥,含有少量蒸馏水
d定容时俯视刻度线
e定容摇匀后发现溶液体积低于刻度线,再补加少量蒸馏水至刻度线
实验室里要配制465 mL 0.2 mol/L的硫酸钠溶液。
(1)请填写下列空白:
| A.计算、称量、溶解:在天平上称出________g硫酸钠固体,把它放在烧杯里,用适量的蒸馏水溶解。 |
| B.转移:把得到的溶液冷却后小心地沿着________注入________中。 |
| C.洗涤:用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤液也小心转入容量瓶中。 |
| D.定容:继续向容量瓶中加蒸馏水至液面距刻度线1~2 cm,改用________小心滴加蒸馏水至溶液凹液面底部与刻度线相切。 |
E.摇匀:将瓶塞塞紧,充分摇匀。
F.贴标签、装试剂瓶:将配好的溶液倒入试剂瓶中,贴上标签,并洗涤容量瓶。
(2)下列情况会使所配溶液浓度偏高的是________(填字母)。
a.某同学定容时俯时容量瓶刻度线
b.没有进行上述的操作步骤C
c.摇匀后发现液面低于刻度线又加水了
d.进行B操作时将少量液体洒到外面
e.未冷却至室温就进行转移
实验室欲配制480 mL 0.1 mol•L-1 Na2CO3溶液,请据此回答下列问题:
(1)实验时,应用托盘天平称取Na2CO3·10H2O晶体 g。
(2)在配制Na2CO3溶液时需用的玻璃仪器主要有量筒、烧杯、玻璃棒、 、 。
(3)若实验过程中遇到下列情况,则会造成所配溶液的浓度偏低的是 。(填字母)
| A.容量瓶内壁附有水珠而未干燥处理 |
| B.忘记将洗涤液加入容量瓶 |
| C.定容时俯视刻度线 |
| D.摇匀后发现液面低于刻度线,加水至凹液面恰好与刻度线相切 |
(1)下列有关实验操作或判断正确的是 (填序号,多选扣分)。
A.将配制好一定物质的量浓度的溶液,注入含有少量水的试剂瓶中,浓度不受影响。
B.用托盘天平称取5.85g氯化钠固体
C.苯、CCl4可用来萃取溴水中的溴。
D.需要95 mL 0.1 mol/L NaCl溶液,一般用100 mL容量瓶进行配制。
E.在天平左右两盘中各放一张白纸后,即可将NaOH固体放在白纸上称量。
F.观察钾元素焰色反应的操作是:先将铂丝放在稀盐酸中洗涤,然后蘸取固体氯化钾,置于酒精灯的火焰上进行灼烧,观察观察火焰的颜色。
(2)①容量瓶上含有下列量中的(填写字母)
A 压强 B 温度 C 容积 D 密度 E 刻度线
②用浓硫酸配制500mL2mol∙L-1硫酸溶液时,所需的玻璃仪器除烧杯、量筒、玻璃棒和胶头滴管之外,还需要 (填仪器名称);在下列配制过程示意图中,有错误的是 (填写序号。

③现要用容量瓶配制500mL0.4mol∙L-1Na2CO3溶液,配好的溶液倒入试剂瓶后需要贴上标签。请你帮助把下图标签上的内容填上去。

④下列情况将使配制溶液的物质的量浓度偏低的有 (填序号)。
A. 容量瓶用蒸馏水洗净后,未待干燥便用来配制
B. NaOH溶解后趁热移入容量瓶中
C. 定容时,俯视刻度线
D. 摇匀后发现液面未到刻度线,继续加水至刻度线
用18 mol·L-1浓硫酸配制100 mL 2.5 mol·L-1稀硫酸的实验步骤如下:
①计算所用浓硫酸的体积 ②量取一定体积的浓硫酸 ③溶解 ④转移 ⑤洗涤 ⑥定容 ⑦摇匀 完成下列问题:
(1)所需浓硫酸的体积是________(保留三位有效数字),量取浓硫酸所用的量筒的规格是________(从下列中选用
| A.10 mL | B.25 mL | C.50 mL | D.100 mL)。 |
(2)该实验用到的仪器除量筒外还有 。
(3)第⑤步实验的操作是________________________________。
(4)第⑥步实验的操作是________________________________。
(5)下列情况对所配制的稀硫酸浓度有何影响?(用“偏大”“偏小”“无影响”填写)
①用量筒量取浓硫酸时俯视刻度___________________。
②容量瓶用蒸馏洗涤后未干燥________________。
③浓硫酸溶解后未冷却即转移、定容________________。
④定容时仰视刻度线________________。
某研究性学习小组欲用化学方法测量一个不规则的容器的体积,取14.3g Na2CO3·10H2O放入100ml烧杯中,加入50mL水配成溶液,将溶液转移到该容器中,用蒸馏水稀释到完全充满该容器,从中取出10mL该溶液,然后逐滴滴入质量分数为3.65%(密度为1g/cm3)的稀盐酸直至没有气体放出为止,用去该稀盐酸10ml,
求:(1)该容器的容积
(2)所得CO2在标况下的体积
掌握仪器名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置。
(1)写出下列仪器的名称: b.
(2)利用装置I分离四氯化碳和酒精的混合物时,冷凝水由 (填f或g)口通入。
(3)现需配制0.1mol/LNaOH溶液500mL,装置II是某同学转移溶液的示意图。

①图中的错误是 。
②配制溶液时,其正确的操作顺序是(用字母表示,每个字母只能用一次) ________。
A.将容量瓶盖紧,振荡,摇匀
B.改用胶头滴管加水,使溶液凹面恰好与刻度相切
C.继续往容量瓶内小心加水,直到液面接近刻度2~3cm处
D.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶
E.将溶解的氢氧化钠溶液沿玻璃棒注入500mL的容量瓶中
F.准确称取计算量的氢氧化钠固体于烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解
③配制溶液时下列操作会造成所配溶液浓度偏小的是( )
A.称量后转移固体时不小心把少量固体洒到烧杯外
B.干净的容量瓶又用蒸馏水洗涤了一遍
C.转移过程中不小心把几滴溶液滴在外面
D.加水定容时,俯视容量瓶刻度线读数
实验室用63%的浓硝酸(其密度为1.4g/mL)配制240mL0.50mol/L稀硝酸,若实验仪器有:A 10mL量筒 B 50mL量筒 C 托盘天平 D 玻璃棒 E 100mL容量瓶 F 250mL容量瓶 G 500mL容量瓶 H 胶头滴管 I 200mL烧杯。
(1)此浓硝酸的物质的量浓度为 mol/L
(2)应量取63%的浓硝酸 mL,应选用 。(填仪器的字母编号)
(3)实验时还需选用的仪器有(填序号)
| A.I、 (4)配制过程中,下列操作会使配制的稀硝酸溶液浓度偏高的是(填序号)。 ①量取浓硝酸的量筒用蒸馏水洗涤2~3次,丙把洗涤液转入容量瓶 ②容量瓶使用时未干燥 ③溶解后未经冷却就移液 ④定容时不小心又少量蒸馏水滴到瓶外 ⑤定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线 (5)容量瓶是一种颈部细长的梨形瓶,哟与其颈部细长,所以在向容量瓶中移入液体时,需要一定耐心和技巧。有人建议将容量瓶的瓶颈改粗,对该建议的正确评价是 |
| B.可以按此建议改进,便于使用容量瓶 |
| C.不能按此建议改进,因为会降低容量瓶的精确度 |
| D.不必加粗瓶颈,因为向容量平中转移液体时,有少量液体倒出瓶外,不会对溶液的浓度产生太大影响 |
某实验室从化学试剂商店买回密度为1.84g/cm3、质量分数为98%的“化学纯”硫酸。现用该浓硫酸配制90mL、1mol/L的稀硫酸。可供选用的仪器有:
①胶头滴管;②烧瓶;③烧杯;④药匙;⑤量筒;⑥托盘天平.请回答下列问题:
(1)配制稀硫酸时,上述仪器中不需要使用的有___________(选填序号),还缺少的仪器有__________。
(2)配制100mL 1mol•L-1的稀硫酸需要上述浓硫酸的体积为________ mL(保留一位小数),量取浓硫酸时应选用_______(选填①10mL、②50mL、③100mL)规格的量筒。
(3)实验中造成所配溶液浓度偏高的原因可能是________
| A.容量瓶中原来含有少量蒸馏水 |
| B.未经冷却,立即转移至容量瓶并洗涤烧杯,定容 |
| C.烧杯没有洗涤 |
| D.向容量瓶中加水定容时眼睛一直仰视刻度线 |
(4)若实验过程中出现如下情况应如何处理?加蒸馏水不慎超过了刻度线_______
实验室配制500mL0.1mol/LNa2CO3溶液。回答下列问题
(1) 用托盘天平应称取十水碳酸钠(Na2CO3·10H2O)晶体的质量为 。
(2) 用托盘天平和小烧杯称出碳酸钠晶体的质量,其正确操作顺序的编号为(同一步骤可用多次): B→( )→( )→( )→B→( )→( )→( )。
A、调整零点
B、将游码移至刻度尺的零刻度处
C、将碳酸钠晶体放入小烧杯中称量
D、称量空的小烧杯
E、将砝码放回砝码盒内
F、记录称量结果.
(3) 本实验需用的主要仪器有
(4) 若实验遇下列情况,溶液的浓度是偏高,偏低还是不变?
A、定容时俯视刻度线
B、没有将洗涤液转入容量瓶
C、容量瓶内壁附有水珠而未干燥处理
下图为实验室某浓盐酸试剂瓶标签上的有关数据,请回答下列问题:

(1)该浓盐酸中HCl的物质的量浓度为 mol·L-1。
(2)某学生欲用上述浓盐酸和蒸馏水配制500mL物质的量浓度为0.400 mol·L-1的稀盐酸。
①该学生需要量取 mL上述浓盐酸进行配制。
②在下列实验仪器中,配制时不必使用的是 (填字母)。
A 500mL容量瓶 B 250mL容量瓶 C 胶头滴管 D 250mL烧杯 E 试管
上述实验中,还必须使用 ,它的作用是 。
③在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(填“偏大”、“偏小”或“无影响”)?
a.用量筒量取浓盐酸时俯视观察凹液面
b.定容时仰视刻度线
I.蒸馏是对混合物进行分离提纯的一种重要方法,其装置如图I。

(1)仪器a的名称是 。
(2)已知CCl4的沸点为76.7℃,甲苯的沸点为110.6℃。若要从它们的混合物中分离出CCl4,应将温度控制在 。
II.实验室需用230mL0.46 mol·L-1的稀硫酸,用质量分数为98%的浓硫酸(密度为1.84g·cm-3)来配制,则:
(1)需要量取该浓硫酸的体积为 mL;
(2)实验所用到的玻璃仪器除烧杯、玻璃棒外,还有 ;
(3)配制过程中部分步骤和操作如图所示:将上述实验步骤A—F按实验过程先后次序排列 。操作ABE用到了一种共同仪器,该仪器上标有:①温度、②浓度、③规格、④压强、⑤刻度线这五项中的 。(填数字符号)
(4)该同学实际配制得到的浓度为0.45 mol·L-1,可能的原因是
| A.量取浓H2SO4时仰视刻度 |
| B.容量瓶洗净后未经干燥处理 |
| C.没有将洗涤液转入容量瓶 |
| D.定容时仰视刻度 |
实验室欲用NaOH固体配制1.0 mol/L的NaOH溶液240 mL;
(1)配制溶液时,一般可以分为以下几个步骤:
①称量 ②计算 ③溶解 ④摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却 ⑨摇动
其正确的操作顺序为_________。本实验必须用到的仪器有天平、药匙、玻璃棒、烧杯、________________。
(2)某同学欲称量NaOH的质量,他先用托盘天平称量烧杯的质量,天平平衡后的状态如下图所示。烧杯的实际质量为________g,要完成本实验该同学应称出________g NaOH。
(3)使用容量瓶前必须进行的一步操作是________。
(4)在配制过程中,其他操作都是正确的,下列操作会引起误差偏高的是________。
| A.转移溶液时不慎有少量洒到容量瓶外面 |
| B.定容时俯视刻度线 |
| C.未冷却到室温就将溶液转移到容量瓶并定容 |
| D.定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线 |
实验室需要0.1mol/LNaOH溶液450mL和0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题.
(1)在图所示仪器中,配制上述溶液肯定不需要的是______(填序号),除图中已有仪器外,配制上述溶液还需要的玻璃仪器是______.
(2)在容量瓶的使用方法中,下列操作不正确的是______
| A.使用容量瓶前检验是否漏水 |
| B.容量瓶用水洗净后,再用待配溶液洗涤 |
| C.配制溶液时,如果试样是固体,把称好的固体用纸条小心倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线. |
| D.配制溶液时,若试样是液体,用量筒取样后用玻璃棒引流倒入容量瓶中,缓慢加水至刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线. |
E.盖好瓶塞,用食指顶住瓶塞,另一只手的手指托住瓶底,把容量瓶反复倒转多次,摇匀.
(3)根据计算用托盘天平称取NaOH固体的质量为______g.在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度______0.1mol/L(填“大于”“小于”或“等于”).
(4)根据计算得知,需用量筒量取质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为______mL,如果实验室有15mL、20mL、50mL量筒,应选用______mL量筒最好.
实验需要0.1mol/LNaOH溶液450ml,根据溶液配制中情况回答下列问题:
(1)实验中必须用到的玻璃仪器有: 。
(2)根据计算得知,所需NaOH的质量为 g。
(3)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次) ;
A.用50mL水洗涤烧杯2-3次,洗涤液均注入容量瓶,振荡
B.用托盘天平准确称量取所需的NaOH的质量,倒入烧杯中加入适量水,用玻璃棒慢慢搅动。
C.将已冷却的NaOH溶液沿玻璃棒注入500mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.加水至离刻度线1~2cm处改用胶头滴管加水,使溶液凹面恰好与刻度相切
(4)下列操作对所配浓度有何影响(填写字母)
偏大的有 ;
偏小的有 ;
无影响的有 。
A.称量用了生锈的砝码;
B.将NaOH放在纸张上称量;
C.NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中;
D.往容量瓶转移时,有少量液体溅出
E.未洗涤溶解NaOH的烧杯
F.定容时仰视刻度线
G.容量瓶未干燥即用来配制溶液
H.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线。
试题篮
()