下列对“改变反应条件,导致化学反应速率改变”的原因描述不正确的是
| A.增大反应物的浓度,活化分子百分数增加,反应速率加快 |
| B.增大气体反应的压强,单位体积中活化分子数增多,气体反应速率加快 |
| C.升高温度能使化学反应速率增大,主要原因是增加了活化分子的百分数,从而使有效碰撞频率提高 |
| D.催化剂通过改变反应路径,使反应所需的活化能降低,反应速率增大 |
在密闭容器中充入一定量的NO2,发生反应2NO2(g) N2O4(g)
N2O4(g)  =-57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如下图所示。下列说法正确的是
=-57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如下图所示。下列说法正确的是

| A.a、c两点的反应速率:a>c |
| B.a、b两点NO2的转化率:a<b |
| C.a、c两点气体的颜色:a深,c浅 |
| D.由a点到b点,可以用加热的方法 |
一定条件下,向2L密闭容器中加入2molN2和10molH2,发生反应N2 + 3H2 2NH3,2min时测得剩余N2为1mol,下列化学反应速率表示不正确的是
2NH3,2min时测得剩余N2为1mol,下列化学反应速率表示不正确的是
| A.v(N2) = 0.25mol/(L·min) | B.v(H2) = 0.75mol/(L·min) |
| C.v(NH3) = 1mol/(L·min) | D.v(NH3) = 0.5mol/(L·min) |
【化学──选修2:化学与技术】

以黄铁矿(主要成分是FeS2)为原料生产硫酸的工艺流程图如下:

(1)依据工艺流程图判断下列说法不正确的是(选填序号字母)___________。
| A.为使黄铁矿充分燃烧,需将其粉碎 |
| B.过量空气能提高SO2的转化率 |
| C.排出的矿渣可供炼铁 |
| D.使用催化剂能提高SO2的化学反应速率和转化率 |
E.设备I生成的气体经净化的主要目的是防止催化剂中毒
F.热交换器的目的是使SO2的热量传递给SO3,有利于SO2的氧化和SO3的吸收
(2)设备Ⅰ的名称为 ,燃烧黄铁矿的化学方程式为 。
(3)设备Ⅱ为接触室,采用常压而不采用高压的原因是 。在生产中,为提高催化剂效率采取的措施有 。
(4)设备Ⅲ为吸收塔,从顶部喷淋 吸收SO3,得到 ,不用水吸收SO3是为了 。吸收塔中填充有许多瓷管,其作用是 。
(5)吸收塔排出的尾气先用氨水吸收,再用浓硫酸处理,得到较高浓度的SO2和铵盐。SO2既可作为原料循环再利用,也可用于工业制溴过程中吸收潮湿空气中的Br2。SO2吸收Br2的离子方程式是 。
Ⅰ、某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。
(1)写出反应的化学方程式 。
(2)根据上述反应可推知______________。
a.氧化性:KBrO3>H3AsO4 b.氧化性:H3AsO4>KBrO3
c.还原性:ASH3>X d.还原性:X>ASH3
Ⅱ、2013年初,雾霾天气多次肆虐我国中东部地区。其中,汽车尾气和燃煤尾气是造成空气污染的原因之一。
(1)汽车尾气净化的主要原理为:2NO(g)+2CO(g) 2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如右图所示。
2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如右图所示。
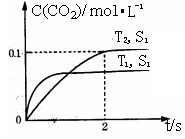
据此判断:
①该反应的△H 0(填“>”、“<”)。
②在T2温度下,0~2s内的平均反应速率v(N2)= 。
③当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。若催化剂的表面积S1>S2,在上图中画出c(CO2)在T1、S2条件下达到平衡过程中的变化曲线。
④若该反应在恒容的密闭体系中进行,下列示意图正确且能说明该反应进行到t1时刻达到平衡状态的是 (填代号) 。
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。
①煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOX可以消除氮氧化物的污染。例如:
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) ΔH1=-867 kJ/mol
2NO2(g)  N2O4(g) ΔH2=-56.9 kJ/mol
N2O4(g) ΔH2=-56.9 kJ/mol
写出CH4 (g)催化还原N2O4(g)生成N2 (g)和H2O (g)的热化学方程式 。
②将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的。右图是通过人工光合作用,以CO2和H2O为原料制备HCOOH和O2的原理示意图。催化剂b表面发生的电极反应式为 。

甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产。工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO(g)+ 2H2(g) CH3OH(g) △H1=-116 kJ·mol-1
CH3OH(g) △H1=-116 kJ·mol-1
(1)下列措施中既有利于增大反应速率又有利于提高CO转化率的是_____________。
| A.随时将CH3OH与反应混合物分离 |
| B.降低反应温度 |
| C.增大体系压强 |
| D.使用高效催化剂 |
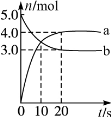
(2)在容积为1L的恒容容器中,分别研究在230℃、250℃、270℃三种温度下合成甲醇的规律。右图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。请回答:

①在上述三种温度中,曲线Z对应的温度是
②利用图中a点对应的数据,计算出曲线Z在对应温度下CO(g)+ 2H2(g)  CH3OH(g)的平衡常数 K= 。
CH3OH(g)的平衡常数 K= 。
(3)在某温度下,将一定量的CO和H2投入10L的密闭容器中,5min时达到平衡,各物质的物质的浓度(mol•L-1)变化如下表所示:
| |
0min |
5min |
10min |
| CO |
0.1 |
|
0.05 |
| H2 |
0.2 |
|
0.2 |
| CH3OH |
0 |
0.04 |
0.05 |
若5min~10min只改变了某一条件,所改变的条件是 ;且该条件所改变的量是
可逆反应:2A(g) + 2B(g)  C(g) + 3D(g) 在不同情况下测得下列4种反应速率,其中反应最快的是
C(g) + 3D(g) 在不同情况下测得下列4种反应速率,其中反应最快的是
A. v(A) = 0.45mol/(L·s) B. v(B) = 0.6mol/(L·s)
C. v(C) = 0.5mol/(L·min) D. v(D) = 0.4mol/(L·s)
一定量的盐酸跟过量的铁粉反应时,为了减缓反应速度,且不影响生成氢气的总量,可向盐酸中加入适量的
①NaOH固体 ②H2O ③NH4Cl固体 ④CH3COONa固体 ⑤NaNO3固体 ⑥KCl溶液
| A.②④⑥ | B.①② | C.②③⑤ | D.②④⑤⑥ |
在用稀硫酸与锌制取氢气的实验中,加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)加入少量硫酸铜溶液可以加快氢气生成速率的原因是 ;
(2)要加快上述实验中气体产生的速率,还可采取的措施有 , (答两种);
(3)为了进一步研究上述反应中硫酸铜的量对氢气生成速率的影响,某学习小组设计了如下6组实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
| 实 验 混合溶液 |
A |
B |
C |
D |
E |
F |
| 4 mol·L-1H2SO4 / mL |
30 |
V1 |
V2 |
V3 |
V4 |
V5 |
| 饱和CuSO4溶液 / mL |
0 |
0.5 |
2.5 |
5 |
V6 |
20 |
| H2O / mL |
V7 |
V8 |
V9 |
15 |
10 |
0 |
请完成此实验设计,其中:其中:V2 V5(填“>”、“<”或“=”);
V5= , V6= ,V8= ;(填具体数值)
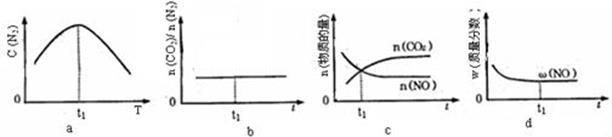
N2O5是一种新型硝化剂,其性质和制备受到人们的关注。一定温度下,在2 L固定容积的密闭容器中发生反应:2N2O5(g) 4NO2(g)+O2(g)ΔH>0。反应物和部分生成物的物质的量随反应时间变化的曲线如图所示。下列说法中,正确的是( )
4NO2(g)+O2(g)ΔH>0。反应物和部分生成物的物质的量随反应时间变化的曲线如图所示。下列说法中,正确的是( )
| A.0~20 s内平均反应速率v(N2O5)=0.1 mol·(L·s)-1 |
| B.10 s时,正、逆反应速率相等,达到平衡 |
| C.20 s时,正反应速率大于逆反应速率 |
| D.曲线a表示NO2的物质的量随反应时间的变化 |
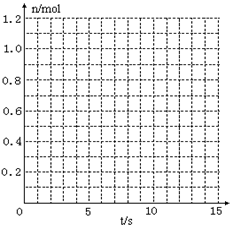
某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如表所示。
(1)根据左表中数据,在右图中画出X、Y、Z的物质的量(n)随时间(t)变化的曲线:
| t/S |
X/mol |
Y/mol |
Z/mol |
 |
| 0 |
1.00 |
1.00 |
0.00 |
|
| 1 |
0.90 |
0.80 |
0.20 |
|
| 3 |
0.75 |
0.50 |
0.50 |
|
| 5 |
0.65 |
0.30 |
0.70 |
|
| 9 |
0.55 |
0.10 |
0.90 |
|
| 10 |
0.55 |
0.10 |
0.90 |
|
| 14 |
0.55 |
0.10 |
0.90 |
(2)体系中发生反应的化学方程式是______________;
(3)列式计算该反应在0-3S时间内产物Z的平均反应速率:_______________;
(4)该反应达到平衡时反应物X的转化率等于___________________________;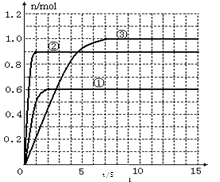
(5) 如果该反应是放热反应。改变实验条件(温度、压强、催化剂)得到Z随时间变化的曲线①、②、③(如右图所示)则曲线①、②、③所对应的实验条件改变分别是:①_________②________③________。
一定温度时,向容积为2L的密闭容器中充入一定量的SO2和O2,发生反应:2SO2(g)+O2(g) 2SO3(g) ∆H=−196kJ·moL−1,一段时间后达平衡,反应过程中测定的部分数据见下表:
2SO3(g) ∆H=−196kJ·moL−1,一段时间后达平衡,反应过程中测定的部分数据见下表:
| 反应时间/min |
n(SO2)/mol |
n(O2)/mol |
| 0 |
2 |
1 |
| 5 |
1.2 |
|
| 10 |
|
0.4 |
| 15 |
0.8 |
|
下列说法不正确的是
A.反应在前5min的平均速率为v (SO2)=0.08mol·L−1·min−1
B.保持温度不变,向平衡后的容器中再充入0.2molSO2和0.2mol SO3时,v (正)>v (逆)
C.保持其他条件不变,若起始时向容器中充入2molSO3,达平衡时吸收78.4kJ的热量
D.相同温度下,起始时向容器中充入1.5mol SO3,达平衡时SO3的转化率为40%
将4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g) 2C(g)。若经2 s后测得C的浓度为0.6 mol·L-1,现有下列几种说法:
2C(g)。若经2 s后测得C的浓度为0.6 mol·L-1,现有下列几种说法:
①用物质A表示的反应平均速率为0.3 mol·L-1·s-1 ②用物质B表示的反应的平均速率为0.6 mol·L-1·s-1 ③2 s时物质A的转化率为70% ④2 s时物质B的浓度为0.7 mol·L-1。 其中正确的是
| A.①③ | B.①④ | C.②③ | D.③④ |
某反应A(g)+3B(g)==2C(g)+2D(g),在四种不同情况下的反应速率分别为:
①υ(A)==0.15mol/(L·s);②υ(B)="=0.6" mol/(L·s);
③υ(C)="=0.4" mol/(L·s);④υ(D)="=0.45" mol/(L·s)。
该反应进行得最快的是( )
A.① B.②③ C.①④ D.④
试题篮
()