在 A+2B  3C+4D 反应中,表示该反应速率最快的是 ( )
3C+4D 反应中,表示该反应速率最快的是 ( )
A.v(A)=0.3 mol/(L·s) B.v(B)=0.5 mol/(L·s)
C.v(C)=0.8 mol/(L·s) D.v(D)=1 mol/(L·min)
运用相关化学知识进行判断,下列结论错误的是
| A.某吸热反应能自发进行,因此该反应是熵增反应 |
| B.NH4F 水溶液中含有 HF,因此 NH4F 溶液不能存放于玻璃试剂瓶中 |
| C.可燃冰主要是甲烷与水在低温高压下形成的水合物晶体,因此可存在于海底 |
| D.增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成 H2 的速率 |
臭氧是理想的烟气脱硝试剂,其脱硝反应为2NO2(g) + O3(g) N2O5(g) + O2(g),若反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是
N2O5(g) + O2(g),若反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是
| A |
B |
C |
D |
 |
 |
 |
 |
| 升高温度, 平衡常数减小 |
0~3 s内,反应速率为 v(NO2) =" 0.2" mol·L-1 |
t1时仅加入催化剂,平衡正向移动 |
达平衡时,仅改变x,则x为c(O2) |
如图是表示:2X(g)+Y(g) Z(g)+R(s)+Q(g)的气体反应速率(υ)与时间(t)的关系,
Z(g)+R(s)+Q(g)的气体反应速率(υ)与时间(t)的关系,
t1时开始改变条件,则所改变的条件符合曲线的是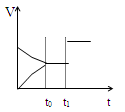
| A.减少Z物质 | B.使用催化剂 | C.升高温度 | D.加大压强 |
在密闭容器中合成氨反应:N2(g)+3H2(g)  2NH3(g),在下列情况下,不能使反应速度加快的是
2NH3(g),在下列情况下,不能使反应速度加快的是
| A.加入氮气 | B.扩大容器体积,减小压强 |
| C.加入适量催化剂 | D.适当升高温度 |
下列情况下,反应速率相同的是
| A.等体积0.1 mol/L HCl和0.05 mol/L H2SO4分别与0.2 mol/L NaOH溶液反应 |
| B.等质量锌粒和锌粉分别与等量1 mol/L HCl反应 |
| C.等体积等浓度HCl和CH3COOH分别与等质量的Na2CO3粉末反应 |
| D.等体积0.2 mol/L HCl和0.1 mol/L H2SO4与等量等表面积等品质石灰石反应 |
使反应4NH3(g)+3O2(g)⇌2N2(g)+6H2O在2L的密闭容器中进行,半分钟后N2的物质的量增加了0.6mol.此反应的平均速率v(X)为
| A.v(NH3)="0.02" mol•L﹣1•s﹣1 | B.v(O2)="0.01" mol•L﹣1•s﹣1 |
| C.v(N2)="0.02" mol•L﹣1•s﹣1 | D.v(H2O)="0.02" mol•L﹣1•s﹣1 |
反应4A(g)+5B(s)═4C(g)+6D(g)在0.5L密闭容器中进行,30s内A减少了0.90mol,则此反应的速率可表示为
A.v(B)=0.075mol/(L•s) B.v(A)=0.030mol/(L•s)
C.v(C)=0.040mol/(L•s) D.v(D)=0.090mol/(L•s)
在2A(g)+B(g) 3C(g)+4D(g)反应中表示该反应速率最快的是 ( )
3C(g)+4D(g)反应中表示该反应速率最快的是 ( )
A.v(A)="0.5mol/(L·" s) B.v(B)="0.3mol/(L·" s)
C.v(C)="0.8mol/(L·" s) D.v(D)="1mol/(L·" s)
下列说法错误的是
| A.决定化学反应速率的主要因素是参加反应的物质的性质 |
| B.升高温度可使吸热反应的反应速率增大,使放热反应的反应速率减小 |
| C.对于有气体参加的反应,增大压强,反应速率加快 |
| D.催化剂能增大单位体积内活化分子的百分数,从而增大化学反应速率 |
为探究外界条件对反应:mA(g)+nB(g) cZ(g) △H的影响,以A和B物质的量之比为m∶n开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如下图所示。下列判断正确的是
cZ(g) △H的影响,以A和B物质的量之比为m∶n开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如下图所示。下列判断正确的是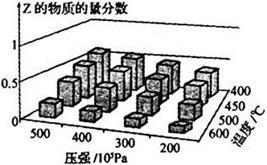
| A.在恒温恒压条件下,向已达到平衡的体系中加入少量Z,达新平衡时,Z的物质的量分数增大 |
| B.升高温度,正、逆反应速率都增大,平衡常数增大 |
| C.△H>0 m+n>c |
| D.温度不变,减小压强,平衡逆向移动,达新平衡时,A的浓度比原平衡减小 |
已知:4NH3+5O2=4NO+6H2O,若反应速率分别用ν(NH3)、ν(O2)、ν(NO)、ν(H2O)表示,则正确的关系是
| A.5ν(NH3)=4ν(O2) | B.5ν(O2)=6ν(H2O) |
| C.2ν(NH3)=3ν(H2O) | D.5ν(O2)=4ν(NO) |
设C+CO2 =2CO;△H>0,反应速率为v1 ;N2 +3H2 =2NH3 ;△H<0,反应速率为v2 ,对于上述反应,当温度升高时,v1 和v2 的变化情况为
| A.同时增大 | B.同时减小 | C.v1 增大,v2减小 | D.v1 减小,v2 增大 |
试题篮
()