在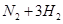
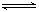
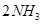 的可逆反应中,自反应开始至2 s末,氨的浓度由0变为0.4
的可逆反应中,自反应开始至2 s末,氨的浓度由0变为0.4 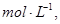 则以氢气的浓度变化表示该反应在2 s内的平均反应速率是
则以氢气的浓度变化表示该反应在2 s内的平均反应速率是
A.0.3 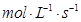 |
B.0.4 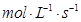 |
C.0.6 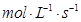 |
D.0.8 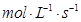 |
实验室用铜与稀硝酸制取NO时,为加快反应速率可采取的措施是
| A.增加铜的用量 | B.增大压强 |
| C.隔绝空气加热 | D.增大硝酸的浓度 |
下列措施中肯定能使化学反应速率增大的是
| A.升高温度 | B.使用催化剂 |
| C.增大压强 | D.增大反应物的量 |
在2A+B 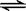 3C+4D中,表示该反应速率最快的是( )
3C+4D中,表示该反应速率最快的是( )
A.υ(A) = 0.5mol·L-1·S-1 B.υ(B) =" 0.3" mol·L-1·S-1
C.υ(C) = 0.8mol·L-1·S-1 D.υ(D)=" 1" mol·L-1·S-1
100mL 6 mol / L H2SO4跟过量锌粉反应,在一定温度下,为了减缓反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量的
| A.硫酸钾溶液 | B.醋酸 | C.氯化钠(固体) | D.盐酸 |
下列有关化学反应速率和限度的说法中,不正确的是 ( )
| A.实验室 用H2O2分解制O2,加入MnO2后,反应速率明显加快 |
| B.在金属钠与足量水反应中,增加水的量能加快反应速率 |
C.2SO2+O2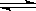 2SO3反应中,SO2的转化率不能达到100% 2SO3反应中,SO2的转化率不能达到100% |
| D.实验室用碳酸钙和盐酸反应制取CO2,用碳酸钙粉末比块状反应要快 |
反应N2+3H2 2NH3刚开始时,N2的浓度为3 mol/L,H2的浓度为5 mol/L,3 min后测得NH3浓度为0.6 mol/L,则此时间内,下列反应速率表示正确的是( )
2NH3刚开始时,N2的浓度为3 mol/L,H2的浓度为5 mol/L,3 min后测得NH3浓度为0.6 mol/L,则此时间内,下列反应速率表示正确的是( )
| A.v(NH3)="0.2" mol/(L·s) | B.v(N2)="1.0" mol/(L·min) |
| C.v(H2)="1.67" mol/(L·min) | D.v(H2)="0.3" mol/(L·min) |
反应4NH3(g)+5O2(g)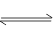 4NO(g)+6H2O(g)在10 L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45 mol,则此反应的平均速率v(X)(反应物的消耗速率或生成物的生成速率)可表示为
4NO(g)+6H2O(g)在10 L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45 mol,则此反应的平均速率v(X)(反应物的消耗速率或生成物的生成速率)可表示为
| A.v(NH3)=0.010 mol·(L·s)-1 | B.v(O2)=0.001 mol·(L·s)-1 |
| C.v(NO)=0.0010 mol·(L·s)-1 | D.v(H2O)=0.045 mol·(L·s)-1 |
用铁片与2mol/L稀硫酸反应制取氢气时,下列措施不能使氢气生成速率减小的是( )
| A.加少量CH3COONa固体 | B.加水 |
| C.加少量CuSO4固体 | D.加等量等浓度Na2SO4溶液 |
反应4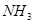 (气)+5
(气)+5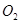 (气)
(气)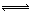 4NO(气)+6
4NO(气)+6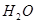 (气)在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.54mol,则此反应的平均速率
(气)在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.54mol,则此反应的平均速率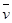 (X)(反应物的消耗速率或产物的生成速率)可表示为 ( )
(X)(反应物的消耗速率或产物的生成速率)可表示为 ( )
A.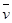 (NH3)=0.0012mol.L-1.s-1 (NH3)=0.0012mol.L-1.s-1 |
B.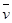 (O2)=0.0125mol.L-1.s-1 (O2)=0.0125mol.L-1.s-1 |
C.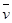 (NO)=0.0010mol.L-1.s-1 (NO)=0.0010mol.L-1.s-1 |
D.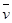 (H2O)=0.054mol.L-1.s-1 (H2O)=0.054mol.L-1.s-1 |
在容积为2L的密闭容器中,有反应:mA (g) + nB (g)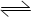 pC (g) + qD (g),经过5分钟达到平衡,此时各物质的变化为A减少为a mol /L,B的平均反应速率VB =" a/15" mol/ (L min),C增加2a / 3 mol/L,这时若增加系统压强,发现A与C的百分含量不变,则m:n:p:q为( )
pC (g) + qD (g),经过5分钟达到平衡,此时各物质的变化为A减少为a mol /L,B的平均反应速率VB =" a/15" mol/ (L min),C增加2a / 3 mol/L,这时若增加系统压强,发现A与C的百分含量不变,则m:n:p:q为( )
| A.3:1:2:2 | B.1:3:2:2 |
| C.1:3:2:1 | D.1:1:1:1 |
在2A+B = 3C+4D反应中,表示该反应速率最快的是 ( )
A.υ(A)="0.5" mol·(L·s)-1 B.υ(B)="0.3" mol·(L·s)-1
C.υ(C)="0.8" mol·(L·s)-1 D.υ(D)="1" mol·(L·s)-1
反应A(g)+3B(g)  2C(g)+2D(g),在不同情况下测得反应速率,反应最快的是( )
2C(g)+2D(g),在不同情况下测得反应速率,反应最快的是( )
A.υ(D)="0.4" mol /( L·min) B.υ(C)="0.5" mol /( L·s)
C.υ(B)="0.6" mol / (L·s) D.υ(A)="0.15" mol /( L·s)
试题篮
()