在一密闭容器中,加入物质A和B后发生反应aA(S)+bB(g)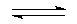 cC(g),此反应是放热反应。关于化学反应速率的叙述正确的是 ( )
cC(g),此反应是放热反应。关于化学反应速率的叙述正确的是 ( )
| A.升高温度时,正反应速率加快,逆反应速率减慢 |
| B.增加少量的A物质,正反应的化学反应速率加快 |
| C.增大压强,正反应速率加快,逆反应速率也加快 |
| D.达到平衡时消耗B的物质的量一定等于消耗C的物质的量 |
下图有关于化学反应速率和化学平衡的四个图像,下列反应中全部符合上述图像的反应是
A.4NH3(g)+5O2(g) 4NO+6H2O(g);△H=-Q1 kJ/mol(Q1>0) 4NO+6H2O(g);△H=-Q1 kJ/mol(Q1>0) |
B.2SO3(g) 2SO2(g)+O2(g);△H=+Q2 kJ/mol(Q2>0) 2SO2(g)+O2(g);△H=+Q2 kJ/mol(Q2>0) |
C.N2(g)+3H2(g) 2NH3(g);△H=-Q3 kJ/mol(Q3>0) 2NH3(g);△H=-Q3 kJ/mol(Q3>0) |
D.H2(g)+ CO(g)  C(s)+H2O(g);△H=+Q4 kJ/mol(Q4>0) C(s)+H2O(g);△H=+Q4 kJ/mol(Q4>0) |
在2A(g)+B(g) 3C(g)+4D(g)反应中,表示该反应速率最快的是
3C(g)+4D(g)反应中,表示该反应速率最快的是
A.v(A)=0.5 mol·L-1·s-1 B.v(B)=0.3 mol·L-1·s-1
C.v(C)=0.8 mol·L-1·s-1 D.v(D)=1 mol·L-1·s-1
在密闭容器中,发生反应2A(g)+B(g) 3C(g)+4D(g),下列情况能够降低该反应速率的是( )
3C(g)+4D(g),下列情况能够降低该反应速率的是( )
| A.缩小容器体积 | B.加入催化剂 |
| C.降低温度 | D.增加气体A的用量 |
在恒温下的VL密闭容器中,有可逆反应2NO(g)+O2(g) 2NO2(g)不能说明已达到平衡状态的是
2NO2(g)不能说明已达到平衡状态的是
| A.正反应生成NO2的速率和逆反应生成O2的速率相等 |
| B.反应器中压强不随时间变化而变化 |
| C.混合气体颜色深浅保持不变 |
| D.混合气体平均分子量保持不变 |
下列关于化学反应速率的说法正确的是
| A.化学反应速率是指一定时间内任何一种反应物物质的量的减少或任何一种生成物物质的量的增加 |
| B.化学反应速率为0.8 mol·(L·s)-1是指1 s 时某物质的浓度为0.8 mol·L-1 |
| C.根据化学反应速率的大小可以知道化学反应进行的快慢 |
| D.对于任何化学反应来说,反应速率越快,反应现象就越明显 |
已知反应A2(g)+2B2(g) 2AB(g)的△H<0,下列说法正确的是
2AB(g)的△H<0,下列说法正确的是
| A.升高温度,正向反应速率增加,逆向反应速率减小 |
| B.升高温度有利于反应速率增加,从而缩短达到平衡的时间 |
| C.达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动 |
| D.达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动 |
在2A+B 3C+4D反应中,表示该反应速率最快的是
3C+4D反应中,表示该反应速率最快的是
A.υ(A)= 0.5 mol /(L·s) B.υ(B)= 0.3 mol /(L·s)
C.υ(C)= 0.8 mol /(L·s) D.υ(D)= 1 mol /(L·s)
下列说法错误的是( )
| A.固体颗粒大小也会影响反应速率 | B.温度越高反应速率也越大 |
| C.加入催化剂一定能加快反应速率 | D.反应速率主要由反应物性质决定 |
在2A+B 3C+4D中,表示该反应速率最快的是( )
3C+4D中,表示该反应速率最快的是( )
A.υ(A) = 0.5mol·L-1·S-1 B.υ(B) =" 0.3" mol·L-1·S-1
C.υ(C) = 0.8mol·L-1·S-1 D.υ(D)=" 1" mol·L-1·S-1
把镁条投入到盛有盐酸的敞口容器里,产生H2的速率可由右图表示。在下列因素中:①盐酸的浓度;②镁条的表面积;③溶液的温度;④Cl-的浓度。影响反应速率的因素是( ) 
| A.①④ | B.③④ | C.①②③ | D.②③ |
对于100 mL 1 mol/L盐酸与锌粉的反应,采取下列措施能使反应速率加快的是
| A.用等量锌粒代替锌粉 | B.改用100 mL 0.5 mol/L盐酸 |
| C.改用300 mL 1 mol/L盐酸 | D.适当升高温度 |
在一密闭容器中加入A、B、C三种气体,保持一定温度,在t1~t4(s)时刻测得各物质的浓度如下表。据此下列结论正确的是( )。
| 测定时刻/s |
t1 |
t2 |
t3 |
t4 |
| c(A)/(mol·L-1) |
6 |
3 |
2 |
2 |
| c(B)/(mol·L-1) |
5 |
3.5 |
3 |
3 |
| c(C)/(mol·L-1) |
1 |
2.5 |
3 |
3 |
A.在t3时刻反应已经停止
B.A的转化率比B的转化率高
C.在容器中发生的反应为:A+2B C
C
D.在t2~t3内A的平均反应速率为 mol·(L·s)-1
mol·(L·s)-1
试题篮
()