(12分) 向某密闭容器中加入0.3mol A、0.08mol C和一定量的B三种气体,一定条件下发生反应,各物质浓度随时间变化如下左图所示[t0~t1阶段的c(B)变化未画出]。右图为t2时刻后改变容器中条件,平衡体系中速率随时间变化的情况,且四个阶段都各改变一种条件,所用条件均不同。已知t4~t5阶段为增大容器体积(即减压)。
(1)写出该反应的化学方程式: 。
(2)若t1 = 30s,则t0~t1阶段以C浓度变化表示的反应速率为v(C) = ;t1~t2的平衡常数K = 。
(3)若t2~t3阶段,C的体积分数在不断地变小,则此阶段没有平衡前v(正) v(逆)(填“>”、“=”或“<”)。
(4)t5~t6阶段改变的条件为 ; B的起始物质的量浓度为 mol/L。
某化学反应2A(g) B(g)+D(g)在密闭容器中分别在下列四种不同条件下进行,B、D起始浓度为0,反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如下表:
B(g)+D(g)在密闭容器中分别在下列四种不同条件下进行,B、D起始浓度为0,反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如下表:
 时间 时间实验序号 |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
|
| 1 |
800 ℃ |
1.0 |
0.80 |
0.67 |
0.57 |
0.50 |
0.50 |
0.50 |
| 2 |
800 ℃ |
c2 |
0.60 |
0.50 |
0.50 |
0.50 |
0.50 |
0.50 |
| 3 |
800 ℃ |
c3 |
0.92 |
0.75 |
0.63 |
0.60 |
0.60 |
0.60 |
| 4 |
T |
1.0 |
0.40 |
0.25 |
0.20 |
0.20 |
0.20 |
0.20 |
根据上述数据,完成下列填空:
(1)实验1中,在10~20 min时间内,以A的速率表示的平均反应速率为 。(2)实验2中,A的初始浓度c2= mol·L-1,反应经20 min就达到平衡,可推测实验2中还隐含的条件是 。
(3)测得实验1和实验3各组分百分含量相等。设实验3的化学反应速率为v3,实验1的化学反应速率为v1,则v3 v1(填“>”“=”或“<”),且c3= mol·L-1。
(4)实验4和实验1仅起始温度不同。比较实验4和实验1,可推测该反应的正反应是 反应(填“吸热”或“放热”),理由是 。
(5)实验4中,假定在50 min将容器的容积缩小为原来的一半,请在下图中用曲线表示体系中各物质的浓度随时间变化的趋势(曲线上必须标出A、B、D)。
一定温度下,向容积为2L的密闭容器中通入3 molA和2mol B,混合气体起始压强为p0。发生如下反应:3A(g)+B(g) xC(g)+ 2D(s),反应进行到1min时测得剩余1.2molA,此时C的浓度为0.6mol/L。反应进行到2min时该容器内混合气体总压强为p,5min后反应达到平衡。
xC(g)+ 2D(s),反应进行到1min时测得剩余1.2molA,此时C的浓度为0.6mol/L。反应进行到2min时该容器内混合气体总压强为p,5min后反应达到平衡。
(1)X为 。
(2)反应在1min内,B的平均反应速率为 ;
(3)请用p0、p来表示2min时反应物B的转化率为 %。
(4)在四种不同的条件下测定得到以下反应速率,其中表示的反应速率最快的是 ;
A.v(A)="0.5" mol·L-1·min-1
B.v(B)="0.2" mol·L-1·min-1
C.v(C)="0.3" mol·L-1·min-1
D.v(D)="0.5" mol·L-1·min-1
(本题16分)降低大气中CO2的含量和有效地开发利用CO2正成为研究的主要课题。
(1)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH =-1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH =-566.0 kJ/mol
③ H2O(g) = H2O(l) ΔH =-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:______________________。
(2)在容积为2L的密闭容器中,充入2mol CO2和6mol H2,在温度500℃时发生反应:
CO2(g)+ 3H2(g) CH3OH(g)+ H2O(g) △H<0。
CH3OH(g)+ H2O(g) △H<0。
CH3OH的浓度随时间变化如图。回答有关问题:
①从反应开始到20分钟时,H2的平均反应速率v(H2)=_________________
②从30分钟到35分钟达到新的平衡,改变的条件可能是__________________________
A.增大压强 B.加入催化剂 C.升高温度 D.增大反应物的浓度
③列式计算该反应在35分钟达到新平衡时的平衡常数(保留2位小数)
④如果在30分钟时,再向容器中充入2mol CO2和6mol H2,保持温度不变,达到新平衡时,CH3OH的浓度____________1mol.L-1(填“>”、“<”或“=”)。
(3)一种原电池的工作原理为:2Na2S2 + NaBr3  Na2S4 + 3NaBr。用该电池为电源,以氢氧化钾水溶液作电解质进行电解,使CO2在铜电极上可转化为甲烷。
Na2S4 + 3NaBr。用该电池为电源,以氢氧化钾水溶液作电解质进行电解,使CO2在铜电极上可转化为甲烷。
①该电池负极的电极反应式为:______________________________________
②电解池中产生CH4一极的电极反应式为: ____________________________________。
(4)下图是NaOH吸收CO2后某种产物的水溶液在pH从0至14的范围内H2CO3、HCO3-、CO32-三种成分平衡时的组成分数。
下列叙述正确的是 _____________
A.此图是1.0 mol·L-1碳酸钠溶液滴定1.0 mol·L-1 HCl溶液的滴定曲线
B.在pH分别为6.37及10.25时,溶液中c(H2CO3)=c(HCO3-)=c(CO32-)
C.人体血液的pH约为7.4,则CO2在血液中多以HCO3-形式存在
D.若用CO2和NaOH反应制取NaHCO3,宜控制溶液的pH为7~9之间
21.(8分)下图装置中,A是由导热材料制成的密闭容器,B是耐化学腐蚀且易于传热的透明气球,关闭K2,将等量且少量的NO2通过K1、K3分别充A、B中,反应起始时,A、B的体积相同均为a L。已知:2NO2(g)  N2O4(g)
N2O4(g) 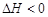


研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
(
)+
(
)

(
)+
(
)
∆
(I)
(
)+
(
)

(
)
∆
(II)
(1)(
)+
(
)

(
)+
(
)+
(
)的平衡常数
= (用
、
表示)。
(2)为研究不同条件对反应(II)的影响,在恒温条件下,向恒容密闭容器中加入
和
,
时反应(II)达到平衡。测得
内
(
)=
×
-
•L-
•
-
,则平衡后n(
)=
,
的转化率
= 。其它条件保持不变,反应(II)在恒压条件下进行,平衡时
的转化率
(填"
""
"或"
"),平衡常数
(填"增大""减小"或"不变"。若要使
减小,可采用的措施是 。
(3)实验室可用溶液吸收
,反应为
+2NaOH=
+
+
。含
NaOH的水溶液与
恰好完全反应得
溶液A,溶液B为
•
‾1的
溶液,则两溶液中c(
‾)、c(
-)和c(
‾)由大到小的顺序为。(已知
的电离常数
=
×
-
•L‾
,
的电离常数
=
×
-
•
‾
,可使溶液A和溶液B的
相等的方法是 () 。
| A. |
a.向溶液A中加适量水 b.向溶液A中加适量 |
某温度下,将2molA和3molB充入体积为2L的密闭容器中进行化学反应:A(g)+B(g) 2C(g) △H< 0,反应进行到10s时达到平衡,此时测得C的物质的量为2.4mol。回答下列问题:
2C(g) △H< 0,反应进行到10s时达到平衡,此时测得C的物质的量为2.4mol。回答下列问题:
(1)0~10s内A的平均反应速率为 。
(2)反应达平衡时B在平衡混合气体中的体积分数为 。
(3)平衡后,其他条件不变的情况下,将体积压缩到原来的1/2时,对反应产生的影响是 。
A.正反应速率增大,逆反应速率减小,平衡向正反应方向移动
B.正、逆反应速率都不变,平衡不移动,各物质物质的量不变
C.正、逆反应速率都增大,平衡不移动,B的物质的量浓度为1.8mol/L
D.正、逆反应速率都增大,平衡不移动,各物质的物质的量不变
(4)可以证明恒温恒容条件下该可逆反应已达到平衡状态的是 。
A.混合气体的密度不随时间而改变
B.混合气体的平均摩尔质量不随时间而改变
C.B和C在混合气体中的体积分数之比不随时间而改变
D.在隔热条件下,体系的温度不随时间而改变
(5)若在其他条件不变的情况下,采取下列措施反应达平衡C的百分含量不变的是 。
A.通入He气 B.使用催化剂
C.升高温度 D.再充入1molA和1.5molB
(6)若保持原温度和容器容积不变再向其中充入2molA和1molB,平衡常数将 (填“增大” “减小”或“不变”),整个过程中物质B的转化率为 。
硝基苯甲酸乙酯在存在下发生水解反应:

.两种反应物的初始浓度均为0.050
,15
时测得:
的转化率
随时间变化的数据如表所示。回答下列问题:
| 0 |
120 |
180 |
240 |
330 |
30 |
600 |
700 |
800 |
|
| 0 |
33.0 |
41.8 |
48.8 |
58.0 |
69.0 |
70.4 |
71.0 |
71.0 |
(1)列式计算该反应在120~180与180~240
区间的平均反应速率、。比较两者大小可得到的结论是。
(2)列式计算15 时该反应的平衡常数。
(3)为提高的平衡转化率,除可适当控制反应温度外,还可以采取的措施有(要求写出两条)。
(16分)甲醇又称“木醇”或“木精”,沸点64.7℃,是无色有酒精气味易挥发的液体。甲醇有毒,误饮5~10mL能双目失明,大量饮用会导致死亡。甲醇是重要的化学工业基础原料和液体燃料,可用于制造甲醛和农药,并常用作有机物的萃取剂和酒精的变性剂等。
(1)工业上可利用CO2和H2生产甲醇,方程式如下:
CO2(g)+3H2(g) CH3OH(l)+H2O (g) △H=Q1kJ·mol-1
CH3OH(l)+H2O (g) △H=Q1kJ·mol-1
又查资料得知:①CH3OH(l)+1/2 O2(g) CO2(g)+2H2(g)△H=Q2kJ·mol-1
CO2(g)+2H2(g)△H=Q2kJ·mol-1
②H2O(g)=H2O(l) △H= Q3kJ·mol-1,则表示甲醇的燃烧热的热化学方程式为 。
(2)工业上可用CO和H2O (g) 来合成CO2和H2,再利用(1)中反应原理合成甲醇。某温度下,将1molCO和1.5molH2O充入10L固定密闭容器中进行化学反应:CO(g)+H2O(g) CO2(g)+H2(g) △H>0,当反应进行到10min时达到平衡,此时测得H2为0.6 mol。回答下列问题:
CO2(g)+H2(g) △H>0,当反应进行到10min时达到平衡,此时测得H2为0.6 mol。回答下列问题:
①0~10min内H2O(g)的平均反应速率为 。
②若想加快正反应速率的同时提高CO的转化率,可以采用的方法是 。
a.升高温度 b.缩小容器的体积
c.增大H2O (g)的浓度 d.加入适当的催化剂
③若保持温度容积不变再向其中充入1molCO和0.5molH2O(g),重新达到化学平衡状态时,此时平衡混合气体中H2的体积分数为 。
(3)甲醇燃料电池是符合绿色化学理念的新型燃料电池,下图是以甲醇燃料电池(甲池)为电源的电解装置。已知:A、B、C、D、E、F都是惰性电极,丙中为0.1 mol/L CuSO4溶液 (假设反应前后溶液体积不变),当向甲池通入气体a和b时,D极附近呈红色。回答下列问题:
① a物质是 ,A电极的电极反应式为 。
② 乙装置中的总化学反应方程式为 。
③ 当乙装置中C电极收集到224mL(标况下)气体时, 丙中溶液的pH= 。
BCl3是重要的化工原料,其沸点12℃。500℃时,向2L的密闭容器中按一定比例投入B2O3、C、Cl2,模拟工业制取三氯化硼的反应如下:B2O3(s) + 3C(s) + 3Cl2(g)  2BCl3 (g) + 3CO(g)。
2BCl3 (g) + 3CO(g)。
(1)反应起始至3min时固体质量减少了15.9克,则氯气的平均反应速率为_____________。
(2)反应至4min时达到平衡,则下列说法正确的是____________(填序号)。
A.3min时,CO的消耗速率大于氯气的消耗速率
B.2min至4min时BCl3的生成速率比0至2min时的快
C.反应起始至平衡,气体的密度不断增大
D.达到平衡后,容器内的压强不再变化
(3)一定条件下,如图所示装置可实现有机物的电化学储氢(忽略其他有机物)。
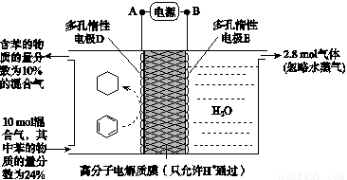
①A、D之间导线中电子移动方向为_______________。(用A、D表示)
②生成目标产物的电极反应式为__________________。
③该储氢装置的电流效率η=____________________。
(η= ×100%,计算结果保留小数点后1位)
×100%,计算结果保留小数点后1位)
向2.0L恒容密闭容器中充入1.0mol PCl5,在温度为T时发生如下反应PCl5(g)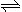 PCl3(g)+ Cl2(g)△H=" +124" kJ•mol-1。反应过程中测定的部分数据见下表:
PCl3(g)+ Cl2(g)△H=" +124" kJ•mol-1。反应过程中测定的部分数据见下表:

回答下列问题:
(1)反应在前50s的平均速率v(PCl5)= ,该反应的△S 0(填“<”、“>”或“=”).
(2)温度为T时,该反应的化学平衡常数= 。
(3)上述反应到达平衡状态时,PCl3的体积分数为 。
要提高平衡时PCl3的体积分数,可采取的措施有 。
| A.温度不变,压缩容器体积增大压强 | B.使用高效催化剂 |
| C.温度和体积不变,减小PCl5的起始量 | D.体积不变,提高反应温度 |
(4)在温度为T时,若起始时向容器中充入0.5mol PCl5和a mol Cl2平衡时PCl5的转化率仍为20%,则a= 。
(5)在热水中,五氯化磷完全水解,生成磷酸(H3PO4),该反应的化学方程式是 。
某科研人员设计出将硫酸渣(主要成分Fe2O3,含有少量的SiO2等杂质)再利用的流程。流程中的滤液经过多次循环后用来后续制备氧化铁粉末。
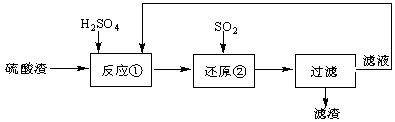
(1)为了加快反应①的反应速率,可采用的措施是 。(写出一点即可)
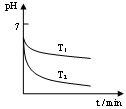
(2)“还原”是将Fe3+转化为Fe2+。在温度T1 、T2(T1 >T2)下进行该反应,通过检测相同时间内溶液的pH,绘制pH随时间的变化曲线如右图所示。得出结论:该反应的温度不宜过高。
①通入SO2气体“还原”时, 试解释pH下降的原因是 。
②相同时间内,T1温度下溶液的pH更高的原因是 。
(3)该流程中循环使用的物质是 。
(4)为测定反应①后溶液中Fe3+的浓度以控制加入SO2的量。实验步骤为:准确量取20.00ml的反应后溶液,稀释成100mL溶液,取10.00 mL溶液,加入足量的KI晶体和2~3滴淀粉溶液,用0.50mol/L的Na2S2O3溶液与碘反应,当反应恰好完全进行时,共消耗Na2S2O3溶液20.00 mL。有关反应方程式如下:2Fe3++2I-=2Fe2++I2; 2Na2S2O3 + I2= Na2S4O6 + 2NaI
试计算原溶液中Fe3+的物质的量浓度(写出计算过程)。
(1)在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:CO(g)+H2O(g) CO2(g)+H2(g);△H<0。CO和H2O浓度变化如下图,则0~4min的平均反应速率v(CO)=______________mol/(L·min)
CO2(g)+H2(g);△H<0。CO和H2O浓度变化如下图,则0~4min的平均反应速率v(CO)=______________mol/(L·min)
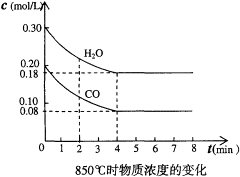
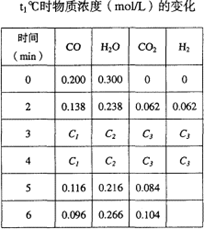
(2)t1℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如右上表。请回答:
①表中3min~4min之间反应处于____________状态;C1数值__________0.08mol/L(填大于、小于或等于)。
②反应在4min~5min问,平衡向逆方向移动,可能的原因是____________(单选),表中5min—6min之间数值发生变化,可能的原因是____________(单选)。
a、增加了水蒸气的量 b、降低温度 c、使用催化剂 d、增加氢气浓度
某温度时,在2 L容器中A、B两种物质间的转化反应中,A、B物质的量随时间变化的曲线如图所示,由图中数据分析得: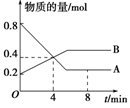
(1)该反应的化学方程式为_________________________________________。
(2)反应开始至4 min时,A的平均反应速率为________________________________。
(3)4 min时,反应是否达到平衡状态?________(填“是”或“否”),8 min时,v(正)________v(逆)(填“>”、“<”或“=”)。
(12分)在100 ℃时,将0.100 mol N2O4气体充入1 L恒容抽空的密闭容器中,隔一定时间对该容器内物质的浓度进行分析得到如表数据:
| 时间(s) |
0 |
20 |
40 |
60 |
80 |
| c(N2O4)/mol·L-1 |
0.100 |
c1 |
0.050 |
c3 |
c4 |
| c(NO2)/mol·L-1 |
0.000 |
0.060 |
c2 |
0.120 |
0.120 |
(1)该反应的平衡常数表达式为________;从表中分析:
c1________c2,c3________c4(填“>”、“<”或“=”)。
(2)在上述条件下,从反应开始直至达到化学平衡时,N2O4的平均反应速率为________mol·L-1·s-1。
(3)达平衡后下列条件的改变可使NO2气体浓度增大的是________(填字母序号)。
A.扩大容器的容积
B.再充入一定量的N2O4
C.分离出一定量的NO2
D.再充入一定量的He
(4)若在相同条件下,起始时只充入0.080 mol NO2气体,则达到平衡时NO2气体的转化率为________。
试题篮
()