500℃时,将H2和N2置于一容积为2 L的密闭容器中发生反应。反应过程中H2、N2和NH3物质的量变化如图所示,分析图像完成下列问题:
(1)0~10分钟,N2的平均反应速率为________mol·L-1·min-1,0~10分钟与10~20分钟两个时间段中,N2的反应速率之比为________。反应在第10 min可能改变的条件是________,运用图像信息说明该条件不是升温的原因:________。
(2)计算500℃时,反应N2+3H2 2NH3的平衡常数K的数值为________。保持温度不变,反应进行至25 min时,抽去0.1 mol氨,此时平衡常数K将________(填“增大”“减小”或“不变”)。保持体积不变,达到新平衡后的正反应的化学反应速率比原平衡状态________(填“大”“小”或“不变”)。
2NH3的平衡常数K的数值为________。保持温度不变,反应进行至25 min时,抽去0.1 mol氨,此时平衡常数K将________(填“增大”“减小”或“不变”)。保持体积不变,达到新平衡后的正反应的化学反应速率比原平衡状态________(填“大”“小”或“不变”)。
(3)在上图中画出25~40 min时间段内N2的物质的量的变化图像。
在一个体积为1 L的密闭容器中发生某化学反应:2A(g) B(g)+C(g),在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800°C,实验Ⅲ在850°C,B、C的起始浓度都为0,反应物A的浓度(mol·L-1)随时间(min)的变化如图所示。
B(g)+C(g),在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800°C,实验Ⅲ在850°C,B、C的起始浓度都为0,反应物A的浓度(mol·L-1)随时间(min)的变化如图所示。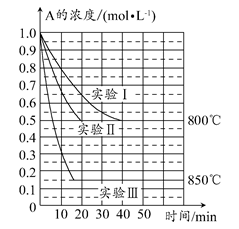
试回答下列问题:
(1)在实验Ⅰ中,反应在20~40 min内A的平均反应速率为________mol·L-1·min-1。实验Ⅱ和实验Ⅰ相比,可能隐含的反应条件是________________。
(2)该反应的ΔH________0,其判断理由是________。
(3)实验Ⅰ第40 min末,若降低反应温度,达到新的平衡后,A的浓度不可能为________(填序号)。
A.0.35 mol·L-1 B.0.4 mol·L-1 C.0.7 mol·L-1 D.0.8 mol·L-1
(4)若反应在800°C进行,在该1 L的密闭容器中加入1 mol A、0.2 mol He,达到平衡时A的转化率应________。
A.等于86% B.等于50%
C.小于50% D.介于50%~86%之间
加0.1 mol MnO2粉末于50 mL过氧化氢(H2O2,ρ=1.1 g· mL-1)中,在标准状况下放出气体的体积和时间的关系如图所示。
(1)实验时放出气体的总体积是_____________________________。
(2)放出一半气体所需时间为_______________________________。
(3)反应放出气体总体积的 所需的时间约为__________________
所需的时间约为__________________
(4)A、B、C、D各点反应速率快慢的顺序为____________________
(5)解释反应速率变化的原因___________________________________________________
(6)计算H2O2的初始物质的量浓度____________________
(7)求反应到2 min时,H2O2的质量分数_________________________
甲酸甲酯水解反应方程式为:HCOOCH3(l)+H2O(l) HCOOH(l)+CH3OH(l) ΔH>0,某小组通过实验研究该反应(反应过程中体积变化忽略不计)。反应体系中各组分的起始量如下表:
HCOOH(l)+CH3OH(l) ΔH>0,某小组通过实验研究该反应(反应过程中体积变化忽略不计)。反应体系中各组分的起始量如下表:
| 组分 |
HCOOCH3 |
H2O |
HCOOH |
CH3OH |
| 物质的量/ mol |
1.00 |
1.99 |
0.01 |
0.52 |
甲酸甲酯转化率在温度T1下随反应时间(t)的变化见下图:
(1)根据上述条件,计算不同时间范围内甲酸甲酯的平均反应速率,结果见下表:
| 反应时间 范围/min |
0~5 |
10~15 |
20~25 |
30~35 |
40~45 |
50~55 |
75~80 |
| 平均反应速率 /(10-3 mol·min-1 |
1.9 |
7.4 |
7.8 |
4.4 |
1.6 |
0.8 |
0.0 |
请计算15~20 min范围内甲酸甲酯的减少量为________ mol,甲酸甲酯的平均反应速率为________ mol·min-1(不要求写出计算过程)。
(2)依据以上数据,写出该反应的反应速率在不同阶段的变化规律及其原因:
____________________________________________________________
(3)其他条件不变,仅改变温度为T2(T2大于T1),画出温度T2下甲酸甲酯转化率随反应时间变化的预期结果示意图。
向某密闭容器中加入0.15 mol/L A、0.05 mol/L C和一定量的B三种气体。一定条件下发生反应,各物质浓度随时间变化如图中甲图所示[t0时c(B)未画出,t1时增大到0.05 mol/L]。乙图为t2时刻后改变反应条件,平衡体系中正、逆反应速率随时间变化的情况。
(1)若t4时改变的条件为减小压强,则B的起始物质的量浓度为_____mol/L。
(2)若t5时改变的条件是升温,此时v(正)>v(逆),若A的物质的量减少0.03 mol时,容器与外界的热交换总量为akJ,写出该反应的热化学方程式_______。
(3)若t1=15s,则t0~t1阶段以C浓度变化表示的平均反应速率为v(C)=_______ mol/L,A的转化率为________。
(4)t3时改变的某一反应条件可能是________(选填序号)。
a.使用催化剂
b.增大压强
c.增大反应物浓度
光气(COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与Cl2在活性炭催化下合成。
已知COCl2(g)  Cl2(g)+CO(g) ΔH=+108 kJ·mol-1。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如下图所示(第10 min到14 min的COCl2浓度变化曲线未示出):
Cl2(g)+CO(g) ΔH=+108 kJ·mol-1。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如下图所示(第10 min到14 min的COCl2浓度变化曲线未示出):
(1)化学平衡常数表达式K=________,计算反应在第8 min时的平衡常数K=________;
(2)比较第2 min反应温度T(2)与第8 min反应温度T(8)的高低:T(2)________T(8)(填“<”、“>”或“=”);
(3)若12 min时反应于温度T(8)下重新达到平衡,则此时c(COCl2)=________;10~12 min内CO的平均反应速率为v(CO)=________;
(4)比较产物CO在2~3min、5~6min和12~13min时平均反应速率(平均反应速率分别以v(2~3)、v(5~6)、v(12~13))的大小________________。
某探究性学习小组用相同质量的锌和相同浓度的足量的稀盐酸反应得到实验数据如下表所示:
| 实验编号 |
锌的状态 |
反应温度/℃ |
收集100 mL氢气 所需时间/s |
| Ⅰ |
薄片 |
15 |
200 |
| Ⅱ |
薄片 |
25 |
90 |
| Ⅲ |
粉末 |
25 |
10 |
(1)该实验的目的是探究________、________对锌和稀盐酸反应速率的影响;
(2)实验Ⅰ和Ⅱ表明________,化学反应速率越大;
(3)能表明固体的表面积对反应速率有影响的实验编号是________和________;
(4)请设计一个实验方案证明盐酸的浓度对该反应的速率的影响:_______________________________________________________________。
(创新预测题)(1)在100 ℃恒温条件下将0.100 mol的N2O4充入体积为1 L的真空密闭容器中,发生反应:N2O4(g) 2NO2(g) ΔH>0。隔一定时间对该容器内的物质进行分析,得到如下数据:
2NO2(g) ΔH>0。隔一定时间对该容器内的物质进行分析,得到如下数据:
| t/s c/(mol·L-1) |
0 |
20 |
40 |
60 |
80 |
100 |
| c(N2O4)/(mol·L-1) |
0.100 |
a |
0.5b |
0.4b |
|
|
| c(NO2)/(mol·L-1) |
0 |
0.060 |
b |
c1 |
c2 |
c3 |
请回答下列问题:
①表中a=______,在0~20 s内N2O4的平均反应速率为_______mol·(L·s)-1。
②已知100 ℃时该反应的平衡常数为0.36,则表中b、c1、c2的大小关系为________,c3=________mol·L-1,达到平衡时N2O4的转化率为_________________。
(2)室温下,把SiO2细粉放入蒸馏水中,不断搅拌,能形成H4SiO4溶液,反应原理如下:
SiO2(s)+2H2O(l) H4SiO4(aq) ΔH
H4SiO4(aq) ΔH
①写出该反应的化学平衡常数K的表达式:________________________________。
②实际上,在地球的深处,由于压强很大,固体、液体都会受到影响。在一定温度下,在10 000 m以下的地球深处,上述反应的方向是________(填“正方向”、“逆方向”或“不移动”),理由是______________________________________。
向一容积不变的密闭容器中充入一定量A和B,发生反应:xA(g)+2B(s) yC(g) ΔH<0。在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如图所示。请回答下列问题:
yC(g) ΔH<0。在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如图所示。请回答下列问题:
(1)用A的浓度变化表示该反应0~10 min内的平均反应速率v(A)=________。
(2)根据图示可确定x∶y=________。
(3)0~10 min容器内压强________(填“变大”、“不变”或“变小”)。
(4)推测第10 min引起曲线变化的反应条件可能是________;第16 min引起曲线变化的反应条件可能是________。
①减压 ②增大A的浓度 ③增大C的量 ④升温
⑤降温 ⑥加催化剂
(5)若平衡Ⅰ的平衡常数为K1,平衡Ⅱ的平衡常数为K2,则K1________K2(填“>”、“=”或“<”)。
温度为T时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,反应PCl5(g)=PCl3(g)+Cl2(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
| t/s |
0 |
50 |
150 |
250 |
350 |
| n(PCl3)/mol |
0 |
0.16 |
0.19 |
0.20 |
0.20 |
下列说法正确的是 ( )
A.反应在前50 s 的平均速率v(PCl3)= 0.0032 mol·L-1·s-1
B.保持其他条件不变,升高温度,平衡时c(PCl3)= 0.11 mol·L-1,则反应的ΔH<0
C.相同温度下,起始时向容器中充入1.0 mol PCl5、0.20 mol PCl3和0.20 mol Cl2,反应达到平衡前v(正)>v(逆)
D.相同温度下,起始时向容器中充入2.0 mol PCl3和2.0 mol Cl2,达到平衡时,PCl3的转化率大于80%
碳和碳的化合物广泛的存在于我们的生活中。
(1)根据下列反应的能量变化示意图,2C(s) +O2(g) =2CO(g) △H= 。
(2)在体积为2L的密闭容器中,充人1 mol CO2和3mol H,一定条件下发生反应: CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H<O测得CO2(g)和CH3OH(g)的物质的量随时间变化的曲线如图所示:
CH3OH(g)+H2O(g) △H<O测得CO2(g)和CH3OH(g)的物质的量随时间变化的曲线如图所示:
①从反应开始到平衡,H2O的平均反应速率v(H2O)= 。
②下列措施中能使化学平衡向正反应方向移动的是 (填编号)。
A.升高温度 B.将CH3OH(g)及时液化移出
C.选择高效催化剂 D.再充入l mol CO2和4 mol H2
(3)CO2溶于水生成碳酸。已知下列数据:
| 弱电解质 |
H2CO3 |
NH3.H2O |
| 电离平衡常数( 25℃) |
Ka1 = 4.30 × 10一7 Ka2= 5.61× 10一11 |
Kb = 1.77× 10一5 |
现有常温下1 mol·L-1的( NH4)2CO3溶液,已知: 水解的平衡常数Kh=Kw/Kb,
水解的平衡常数Kh=Kw/Kb,
第一步水解的平衡常数Kh=Kw/Ka2。
①判断该溶液呈 (填“酸”、“中”、 “碱”)性,写出该溶液中 发生第一步水解的离子方程式 。
发生第一步水解的离子方程式 。
②下列粒子之间的关系式,其中正确的是 。
A.
B.
C.
D.
(4)据报道,科学家在实验室已研制出在燃料电池的反应容器中,利用特殊电极材料以CO和O2为原料做成电池。原理如图所示:通入CO的管口是 (填“c”或“d”),写出该电极的电极反应式: 。
硫的化合物在生产和科研中发挥着重要作用。
(1)SO2Cl2常用于制造医药品、染料、表面活性剂等。已知:SO2Cl2(g) SO2(g)+Cl2(g) △H=+97.3 kJ·mol-1。某温度时向体积为1 L的恒容密闭容器中充入0. 20mol SO2Cl2,达到平衡时,容器中含0.18mol SO2,则此过程反应吸收的热量为_____kJ,该温度时反应的平衡常数为_____。将上述所得混合气体溶于足量BaCl2溶液中,最终生成沉淀的质量为_______。
SO2(g)+Cl2(g) △H=+97.3 kJ·mol-1。某温度时向体积为1 L的恒容密闭容器中充入0. 20mol SO2Cl2,达到平衡时,容器中含0.18mol SO2,则此过程反应吸收的热量为_____kJ,该温度时反应的平衡常数为_____。将上述所得混合气体溶于足量BaCl2溶液中,最终生成沉淀的质量为_______。
(2)工业上制备硫酸的过程中存在反应:2SO2(g)+O2(g) 2SO3(g) △H=-198kJ·mol-1400℃,1.01×105Pa,向容积为2L的恒容密闭容器中充入一定量 SO2和O2,n(SO3)和n(O2)随时间的变化曲线如图所示。
2SO3(g) △H=-198kJ·mol-1400℃,1.01×105Pa,向容积为2L的恒容密闭容器中充入一定量 SO2和O2,n(SO3)和n(O2)随时间的变化曲线如图所示。
①0~20min反应的平均速率υ(O2)=___________。
②下列叙述正确的是 。
a.A点υ正(SO2)>υ逆(SO2)
b.B点处于平衡状态
c.C点和D点n(SO2)相同
d.其它条件不变,500℃时反应达平衡,n(SO3)比图中D点的值大
(3)工业上用Na2SO3溶液吸收烟气中的SO2。将烟气通入1.0 mol·L-1的Na2SO3溶液,当溶液pH约为6时,Na2SO3溶液吸收SO2的能力显著下降,应更换吸收剂。此时溶液中c (SO32-)的浓度是0.2 mol·L-1,则溶液中c(HSO3-)是_________mol·L-1。
某温度时,在2 L容器中A、B两种物质间的转化反应中,A、B物质的量随时间变化的曲线如图所示,由图中数据分析得:
(1)该反应的化学方程式为_________________________________________。
(2)反应开始至4 min时,A的平均反应速率为________________________________。
(3)4 min时,反应是否达到平衡状态?________(填“是”或“否”),8 min时,v(正)________v(逆)(填“>”、“<”或“=”)。
一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的量随时间变化的曲线如图所示:
(1)从反应开始到10 s,用Z表示的反应速率为______。X的物质的量浓度减少了______,Y的转化率为_____________________________________。
(2)该反应的化学方程式为:____________________________________________。
(1)已知:O2 (g)= O2+ (g)+e- △H1=" +1175.7" kJ·mol-1
PtF6(g)+ e-= PtF6-(g) △H2=" -" 771.1 kJ·mol-1
O2+PtF6-(s)=O2+(g)+PtF6- (g) △H3="+482.2" kJ·mol-1
则反应:O2(g)+ PtF6 (g) = O2+PtF6(s)的△H="_____" kJ·mol-1。
如图为合成氨反应在使用相同的催化剂,不同温度和压强条件下进行反 应,初始时N2和H2的体积比为1:3时的平衡混合物中氨的体积分数:
① 在一定的温度下,向体积不变的密闭容器中充入氮气和氢气发生上述反应,下列能说明反应达到平衡状态的是 。
a.体系的压强保持不变 b.混合气体的密度保持不变
c.N2和H2的体积比为1:3 d.混合气体的平均摩尔质量不变
②分别用vA(NH3)和vB(NH3)表示从反应开始到平衡状态A、B时的反应速率,则vA(NH3) vB(NH3)(填“>”、“<”或“=”),该反应的的平衡常数kA kB(填“>”、“<”或“=”),在250 ℃、1.0×104kPa下达到平衡,H2的转化率为 %(计算结果保留小数点后一位);
(3)25℃时,将a mol NH4NO3溶于水,溶液呈酸性,原因 (用离子方程式表示)。向该溶液中加入bL氨水后溶液呈中性,则所加氨水的浓度为 mol/L(用含a、b的代数式表示,NH3·H2O的电离平衡常数为Kb=2×10-5)
(4)如图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒上镀铜。电镀一段时间后,装置Ⅰ中溶液的pH (填“变大”、“变小”或“不变”),a极电极反应方程式为 ;若电镀结束后,发现装置Ⅱ中阴极质量变化了25.6g(溶液中硫酸铜有剩余),则装置Ⅰ中理论上消耗甲烷 L(标准状况下)。
试题篮
()