(7分)(1)某温度下,2L恒容密闭容器中,X、Y、Z三种气体发生化学反应时,物质的量随时间变化的关系曲线如图所示,则
①此反应的化学方程式为________________;
②0~10s内,用Z表示的化学反应速率为________________;
③X的转化率为________________;
(2)恒温恒容时,某密闭容器中发生反应:C(s)+CO2(g) 2CO(g),下列描述中能说明该反应已达到化学平衡状态的是________________。
2CO(g),下列描述中能说明该反应已达到化学平衡状态的是________________。
①C(s)的浓度不再改变 ②CO2的体积分数不再改变
③气体的质量不再改变 ④气体的密度不再改变
⑤单位时间内消耗1molCO2,同时生成2molCO
⑥n(CO2):n(CO)=1:2 ⑦v正(CO2)=2v逆(CO)
硫酸的消费量是衡量一个国家化工生产水平的重要标志。
(1)一定条件下,SO2与空气反应10 min后,SO2和SO3物质的量浓度分别为1.2 mol/L和2.0 mol/L,则SO2起始物质的量浓度为______;生成SO3的化学反应速率为______。
(2)若改变外界条件,发生SO2与空气反应生成SO3,使10 min内的用O2表示的反应速率为0.15mol/(L·min),则改变的条件可能是_______________。
| A.压缩体积,增大压强 | B.降低温度 | C.充入大量的氮气 | D.仅增加SO2的浓度 |
(3)工业制硫酸,用过量的氨水对SO2尾气处理,请写出相关的离子方程式:____ _
已知CO(g)+H2O(g) CO2(g)+H2(g)反应的平衡常数和温度的关系如下:
CO2(g)+H2(g)反应的平衡常数和温度的关系如下:
| |温度/ ℃ |
700 |
800 |
830 |
1000 |
1200 |
| 平衡常数 |
1.7 |
1.1 |
1.0 |
0.6 |
0.4 |
回答下列问题:
(1)该反应的△H 0(填“<”“ >”“ =”);
(2)830℃时,向一个5 L的密闭容器中充入0.20mol的CO和0.80mol的H2O,反应初始6s内CO的平均反应速率v(CO)="0.003" mol·L-1·s-1,则6S末CO2的物质的量浓度为 ;反应经一段时间后,达到平衡后CO的转化率为 ;
(3)判断该反应是否达到平衡的依据为 (填正确选项前的字母);
a.压强不随时间改变 b.气体的密度不随时间改变
c.c(CO)不随时间改变 d.单位时间里生成CO和H2的物质的量相等
(4)已知1000℃时,要使CO的转化率超过90%,则起始物c(H2O): c(CO)应不低于 ;
(5)某燃料电池以CO为燃料,以空气为氧化剂,以熔融态的K2CO3为电解质,请写出该燃料电池正极的电极反应式 ;
(6)已知CO可用于制备很多物质: ΔH=+8.0kJ·mol-1
ΔH=+8.0kJ·mol-1 ΔH=+90.4kJ·mol-1
ΔH=+90.4kJ·mol-1 ΔH=-556.0kJ·mol-1
ΔH=-556.0kJ·mol-1 ΔH=-483.6kJ·mol-1
ΔH=-483.6kJ·mol-1
请写出 与
与 反应生成
反应生成 热化学方程式 。
热化学方程式 。
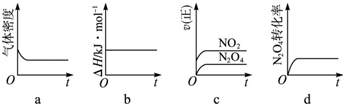
汽车尾气是城市空气的主要污染物之一,其主要有害成分是CO、氮氧化物(NOx)等。
(1)NOx产生的原因之一是汽车发动机工作时引发N2和O2反应,其能量变化值如右图所示,
则:N2(g)+O2(g) 2NO(g) △H= 。
2NO(g) △H= 。
(2)汽车尾气中CO、NOx的有效消除成为环保领域的重要课题。某研究小组在实验室用某新型催化剂对CO、NO催化转化进行研究,测得NO转化为N2的转化率随温度、CO混存量的变化情况如下图一。
① NO与CO混存时,相互反应的化学方程式为 。
② 1000K,n(NO)/n(CO)=5:4时,NO的转化率为75%,则CO的转化率约为 。
③ 由于n(NO)/n(CO)在实际过程中是不断变化的,保证NO转化率较高的措施是将温度大约控制在 K之间。
(3)汽车尾气中NOx有望通过燃料电池实现转化。已经有人以 NO2、O2和熔融NaNO3制成了燃料电池,其原理如图二。
① 图中石墨Ⅱ为电池的 极。
② 在该电池使用过程中,石墨I电极上的产物是氧化物Y,其电极反应式为 。
(4)甲醇也可用于燃料电池。工业上采用反应CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH<0合成甲醇。
CH3OH(g)+H2O(g) ΔH<0合成甲醇。
① 在恒容密闭反应器中,H2的平衡转化率与温度、压强的关
系如图三所示,则A、B、C三点处对应平衡常数(KA、KB、KC)的
大小关系为 。
② 某高温下,将6molCO2和8molH2充入2L密闭容器中发生
反应,达到平衡后测得c(CO2)=2.0mol·L-1,则该温度下反应的平
衡常数值为 。
CO2是生活中常见的化合物之一,随着世界工业经济的发展、人口的剧增,全球能源紧张及世界气候面临越来越严重的问题,人类对CO2的性质研究和综合利用日益重视。
Ⅰ.在催化剂作用下,可由甲醇和CO2直接合成碳酸二甲酯(DMC):CO2 + 2CH3OH → CO(OCH3)2 + H2O,但甲醇转化率通常不会超过1%,这是制约该反应走向工业化的主要原因。某研究小组在其他条件不变的情况下,通过研究温度、反应时间、催化剂用量分别对转化数(TON)的影响来评价催化剂的催化效果。计算公式为:TON=转化的甲醇的物质的量/催化剂的物质的量。
(1)根据反应温度对TON的影响图(相同时间内测定),判断该反应的焓变△H________0(填“>”、“=”或“<”),理由是____________________________________。

(2)根据反应时间对TON的影响图(上图),已知溶液总体积10mL,反应起始时甲醇0.25mol,催化剂0.6×10—5 mol,计算该温度下,4~7 h内DMC的平均反应速率:________。
(3)根据该研究小组的实验及催化剂用量对TON的影响图(见上右图),判断下列说法正确的是 。
A.由甲醇和CO2直接合成DMC,可以利用甲醇把影响环境的温室气体CO2 转化为资源,在资源循环利用和环境保护方面都具有重要意义
B. 在反应体系中添加合适的脱水剂,将提高该反应的TON
C. 当催化剂用量低于1.2×10—5 mol时,随着催化剂用量的增加,甲醇的平衡转化率显著提高
D. 当催化剂用量高于1.2×10—5 mol时,随着催化剂用量的增加DMC的产率反而急剧下降
Ⅱ.如果人体内的CO2不能顺利排除体外会造成酸中毒,缓冲溶液可以抵御外来少量酸或碱对溶液pH的影响,人体血液里主要通过碳酸氢盐缓冲体系(H2CO3/HCO3-)维持pH稳定。己知正常人体血液在正常体温时,H2CO3的一级电离常数Ka1=10-6.1,c(HCO3-):c(H2CO3)≈20:1,lg2=0.3。
(4)由题给数据可算得正常人体血液的pH________(保留一位小数)。
(5)正常人体血液中H2CO3、HCO3-、OH-、H+四种微粒浓度由大到小关系为: 。
(6)当少量的酸、碱进入血液中时,血液pH变化不大,其原因是 。
H2O2是一种强氧化剂,被广泛应用于水处理及卫生消毒等方面。
(1)H2O2不稳定,当其中含Fe2+时,会发生反应:
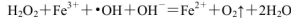 ,则Fe2+在此过程中所起的作用是______________,当生成336mL O2(标准状况)时,反应中转移电子的物质的量为_______mol。
,则Fe2+在此过程中所起的作用是______________,当生成336mL O2(标准状况)时,反应中转移电子的物质的量为_______mol。
(2)下表是在常压、60℃和不同pH条件下,6mL30% H2O2在60min内释放出氧气的体积。则下列说法正确的是___________。
a.pH越大,H2O2的分解速率越大
b.pH在9左右,H2O2的分解速率最大
c.6mL 30% H2O2分解最多释放出的氧气的体积为639mL
d. pH=5.50时,0~60min内,v(O2)=1.5mL
(3)溶液中H2O2的残留量可用一定浓度的酸性KMnO4溶液来测定,反应中MnO4-
被还原为Mn2+,该反应的离子方程式为______________。
(4)科学工作者以Ir-Ru/Ti为阳极、ACFC为阴极,在酸性环境、不断通入空气的条件下直接电解水来制备H2O2。电解过程中,阳极区溶液的pH_ (填“增大”“不变”或“减小”),阴极产生H2O2的电极反应式为_______。若不通空气,则阴极得到的产物是_______ 。
(5)己知断裂1mol化学键所需的能量
143,H-O为463。则 .
.
(17分)运用化学反应原理研究碳的化合物具有重要意义。
(1)常温下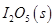 可用于检测CO,反应原理为:
可用于检测CO,反应原理为:
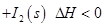 。向2L密闭容器中加入足量
。向2L密闭容器中加入足量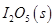 ,并通人1molCO,CO2的体积分数
,并通人1molCO,CO2的体积分数 随时间的变化如下图所示。
随时间的变化如下图所示。
①0~0.5min内的平均反应速率 _____________。
_____________。
②保持温度和体积不变,若开始加入CO(g)的物质的量是原来的2倍,则下列说法正确的是____________(填代号)。
a.生成I2的质量为原来的2倍
b.混合气体的平均摩尔质量不变
c.达到平衡的时间为原来的2倍
d.混合气体的密度不变
③反应达a点时,欲增大容器中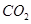 的体积分数
的体积分数 ,可采取的措施为____________。
,可采取的措施为____________。
(2)以 为催化剂,可以将
为催化剂,可以将 的混合气体直接转化为乙酸。
的混合气体直接转化为乙酸。
①若该反应的原子利用率为100%,则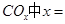 ______________。
______________。
②在25℃下,将pH=a的氢氧化钠溶液与pH=b的醋酸溶液等体积混合,若两溶液恰好完全反应,则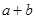 ________14(填“>”、“<”或“=”);该温度下醋酸的电离常数K=__________(用含a、b的式子表示)。
________14(填“>”、“<”或“=”);该温度下醋酸的电离常数K=__________(用含a、b的式子表示)。
(3)利用反应 可以处理汽车尾气,若将该反应设计为原电池,用熔融Na2O作电解质,其正极电极反应式为________________________________。
可以处理汽车尾气,若将该反应设计为原电池,用熔融Na2O作电解质,其正极电极反应式为________________________________。
为有效控制雾霾,各地积极采取措施改善大气质量。有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要。
(1)在汽车排气管内安装催化转化器,可将汽车尾气中主要污染物转化为无毒的大气循环物质。
已知:① N2(g)+O2(g)=2NO(g) △H=+180.5kJ·mol-1
②C和CO的燃烧热(△H)分别为-393.5kJ·mol-1和-283kJ·mol-1
则2NO(g+2CO(g)=N2(g)+2CO2(g)) △H= kJ·mol-1
(2)将0.20 mol NO和0.10 mol CO充入一个容积为1L的密闭容器中,反应过程中物质浓度变化如图所示。
①CO在0-9min内的平均反应速率v(CO)=________mol (保留两位有效数字);第12 min时改变的反应条件可能为________。
(保留两位有效数字);第12 min时改变的反应条件可能为________。
| A.升高温度 | B.加入NO | C.加催化剂 | D.降低温度 |
②该反应在第24 min时达到平衡状态,CO2的体积分数为________(保留三位有效数字),化学平衡常数K=________(保留两位有效数字)。
(3)烟气中的SO2可用某浓度NaOH溶液吸收得到Na2SO3和NaHSO3混合溶液,且所得溶液呈中性,该溶液中c(Na+)=________(用含硫微粒浓度的代数式表示)。
(4)通过人工光合作用能将水与燃煤产生的CO2转化成HCOOH和O2。已知常温下0.1 mol 的HCOONa溶液pH =10,则HCOOH的电离常数
的HCOONa溶液pH =10,则HCOOH的电离常数 =_________。
=_________。
(共7分)工业上用CO生产燃料甲醇。一定温度和容积条件下发生反应:CO(g)+2H2(g) CH3OH(g)。图1表示反应中的能量变化;图2表示一定温度下,在体积为1L的密闭容器中加入2mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化。
CH3OH(g)。图1表示反应中的能量变化;图2表示一定温度下,在体积为1L的密闭容器中加入2mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化。
请回答下列问题:
(1)在“图1”中,曲线 (填“a”或“b”)表示使 用了催化剂;没有使用催化剂时,在该温度和压强条件下反应CO(g)+2H2(g) CH3OH(g)的△H = 。
CH3OH(g)的△H = 。
(2)从反应开始到建立平衡,v(CO)= ;该温度下CO(g)+2H2(g)  CH3OH(g)的化学平衡常数为 。达到平衡后若保持其它条件不变,将反应体系升温,则该反应化学平衡常数____(填“增大”、“减小”或“不变”)。
CH3OH(g)的化学平衡常数为 。达到平衡后若保持其它条件不变,将反应体系升温,则该反应化学平衡常数____(填“增大”、“减小”或“不变”)。
(3)已知CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g)ΔH=- 193kJ/mol,又知H2O(l)= H2O(g) ΔH=+44 kJ/mol,请写出32g的CH3OH(g)完全燃烧生成液态水的热化学方程式 。
(14分)2013年12月2日,我国在西昌卫星发射中心用“长征三号甲”运载火箭将“嫦娥三号”探月卫星成功送入太空,进一步向广寒宫探索。“长征三号甲”是三级液体助推火箭,一、二级为常规燃料,常规燃料通常指以肼(N2H4)为燃料,以二氧化氮做氧化剂。
Ⅰ.常规燃料通常指以肼(N2H4)为燃料,以二氧化氮做氧化剂。但有人认为若用氟气代替二氧化氮作氧化剂,反应释放的能量更大(两者反应生成氮气和氟化氢气体)。
已知:①N2H4(g)+O2(g)=N2(g)+2H2O(g) △H = -543kJ·mol-1
② H2(g)+
H2(g)+  F2(g) = HF(g) △H = -269kJ·mol-1
F2(g) = HF(g) △H = -269kJ·mol-1
③H2(g)+  O2(g) = H2O(g) △H = -242kJ·mol-1
O2(g) = H2O(g) △H = -242kJ·mol-1
请写出肼和氟气反应的热化学方程式:_____________________________。
Ⅱ.氧化剂二氧化氮可由NO和 O2生成,已知在2 L密闭容器内,800 ℃时反应:
2NO(g)+O2(g) 2NO2(g) ΔH 的体系中,n(NO)随时间的变化如表:
2NO2(g) ΔH 的体系中,n(NO)随时间的变化如表:
| 时间(s) |
0 |
1 |
2 |
3 |
4 |
5 |
| n(NO)(mol) |
0.200 |
0.100 |
0.080 |
0.050 |
0.050 |
0.050 |
| n(O2)(mol) |
0.100 |
0.050 |
0.040 |
0.025 |
0.025 |
0.025 |
(1)已知:K800℃>K1000℃,则该反应的ΔH ______0(填“大于”或“小于”),用O2表示从0~2 s内该反应的平均速率为__________。
(2)能说明该反应已达到平衡状态的是________。
A.容器内颜色保持不变 B. 2v逆(NO)=v正(O2)
C.容器内压强保持不变 D.容器内密度保持不变
(3)为使该反应的速率增大,提高NO的转化率,且平衡向正反应方向移动应采取的措施有 。
(4)在上述条件下,计算通入2 mol NO和1 mol O2的平衡常数K=______________。
(5)在上述条件下,若开始通入的是0.2 mol NO2气体,达到化学平衡时,则NO2的转化率为 。
工业废气、汽车尾气排放出的SO2、NOx等,是形成雾霾的重要因素。霾是由空气中的灰尘、硫酸、硝酸、有机碳氢化合物等粒子形成的烟雾。
(1)大气中的SO2在烟尘的催化下形成硫酸的反应方程式是____________________。
(2)已知2SO2 (g)+ O2 (g) 2SO3(g) △H=-196kJ/mol,提高反应中SO2的转化率,是减少SO2排放的有效措施。
2SO3(g) △H=-196kJ/mol,提高反应中SO2的转化率,是减少SO2排放的有效措施。
①T温度时,在2L容积固定不变的密闭容器中加入2.0 mol SO2和1.0 mol O2,5 min后反应达到平衡,二氧化硫的转化率为50%,则υ(O2)=____________。
②在①的条件下,判断该反应达到平衡状态的标志是_______(填字母)。
| A.SO2、O2、SO3三者的浓度之比为2∶1∶2 | B.容器内气体的压强不变 |
| C.容器内混合气体的密度保持不变 | D.SO3的物质的量不再变化 |
E.SO2的生成速率和SO3的生成速率相等
③若反应初始时,在容器中加入1.5 mol SO2和0.8 mol O2,则平衡后二氧化硫的转化率 氧气的转化率(填大于、小于或等于)。
(3)烟气中的SO2可以用NaOH溶液吸收,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如下图所示。(电极材料为石墨)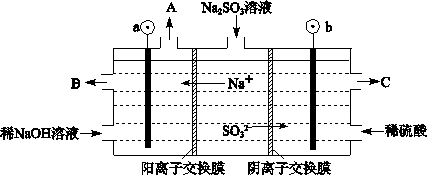
①图中a极要连接电源的(填“正”或“负”)_______极,C口流出的物质是_______。
②SO32-放电的电极反应式为_____________________________________。
③电解过程中若消耗12.6gNa2SO3,则阴极区变化的质量为_______g(假设该过程中所有液体进出口密闭)。
偏二甲肼与是常用的火箭推进剂,二者发生如下化学反应:
(Ⅰ)
(1)反应(Ⅰ)中氧化剂是.
(2)火箭残骸中常现红棕色气体,原因为: (Ⅱ)
当温度升高时,气体颜色变深,则反应(Ⅱ)为(填"吸热"或"放热")反应.
(3)一定温度下,反应(Ⅱ)的焓变为.现将1
充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是 .若在相同温度下,上述反应改在体积为1
的恒容密闭容器中进行,平衡常数(填"增大""不变"或"减小"),反应3
后
的物质的量为0.6
,则0~3
内的平均反应速率
=
.
(4)可用氨水吸收生成
.25℃时,将
溶于水,溶液显酸性,原因是(用离子方程式表示).向该溶液滴加
氨水后溶液呈中性,则滴加氨水的过程中水的电离平衡将填"正向""不"或"逆向")移动,所滴加氨水的浓度为
.(
的电离平衡常数取Kb=2×10﹣5
)
2013年10月我市因台风菲特遭受到重大损失,市疾控中心紧急采购消毒药品,以满足灾后需要。复方过氧化氢消毒剂具有高效、环保、无刺激无残留,其主要成分H2O2是一种无色粘稠液体,请回答下列问题:
⑴火箭发射常以液态肼(N2H4)为燃料,液态H2O2为助燃剂。已知:
N2H4(1)+O2(g)=N2(g)+2H2O(g) △H="-" 534 kJ·mol-1 ①
H2O2(1)=H2O(1)+1/2O2(g) △H="-" 98.64 kJ·mol-1 ②
H2O(1)=H2O(g) △H=+44kJ·mol-l ③
则反应N2H4(1)+2H2O2(1)=N2(g)+4H2O(g)的△H= ,
⑵据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作 原料的燃 料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电,其工作原理如图所示。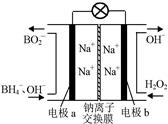
则该电池的正极反应____ ___
⑶H2O2是一种不稳定易分解的物质。右图是H2O2在没有催化剂时反应进程与能量变化图,请在图上画出使用催化剂加快分解速率时能量与进程图 。
⑷某化学兴趣小组欲测定H2O2的分解速率,取溶液0.5L进行分析,数据如表格所示:
| t(S) |
0 |
2 |
4 |
6 |
8 |
10 |
| n(H2O2) (moL) |
0.8 |
0.7 |
0.62 |
0.55 |
0.27 |
0.03 |
在上述表格中已知某一时刻向H2O2溶液中加入催化剂,则加入催化剂后整段时间内H2O2的平均分解速率___________。
⑸H2O2还是一种药物化学分析的氧化剂,能用于药物的分析。

①此检验过程中加过量H2O2反应的离子方程式为______________。
②从红褐色的悬浊液到最后的称量,其过程中所需的基本操作有___________(按操作的顺序填写)。
A.过滤 B.洗涤 C.萃取 D.分液 E.冷却 F.灼烧
③最后称量红棕色固体的质量为0.8960g,那么该药片中硫酸亚铁的质量分数为
_________(小数点后面保留一位有效数字)。
将6molA气体和2molB气体在2L密闭容器中混合并在一定条件下发生反应:3A(g)+B(g) xC(g)+2D(g)。若经5min后反应达到平衡状态,容器内的压强变小,并知D的平均反应速率为0.2mol/(L•min),请填写下列空白:
xC(g)+2D(g)。若经5min后反应达到平衡状态,容器内的压强变小,并知D的平均反应速率为0.2mol/(L•min),请填写下列空白:
①x的数值为 ; ②A的平均反应速率为 ; ③5min时B的转化率为 。
试题篮
()