少量铁片与l00mL 0.01mol/L的稀盐酸反应,反应速率太慢.为了加快此反应速率而不改变H2的产量,可以使用如下方法中的
①加H2O ②加KNO3溶液 ③滴入几滴浓盐酸 ④加入少量铁粉 ⑤加NaCl溶液 ⑥滴入几滴硫酸铜溶液 ⑦升高温度(不考虑盐酸挥发)
⑧改用10mL 0.1mol/L盐酸.
| A.①⑥⑦ | B.③⑤⑧ |
| C.③⑦⑧ | D.③④⑥⑦⑧ |
某化学小组研究在其他条件不变时,改变密闭容器中某一条件对A2(g)+ 3B2(g)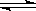 2AB3(g)化学平衡状态的影响,得到如下图所示的曲线(图中T表示温度,n表示物质的量)下列判断正确的是
2AB3(g)化学平衡状态的影响,得到如下图所示的曲线(图中T表示温度,n表示物质的量)下列判断正确的是
A.若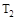 > >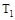 ,则正反应是放热反应 ,则正反应是放热反应 |
B.达到平衡时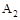 的转化率大小为:b>a>c 的转化率大小为:b>a>c |
C.若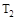 > >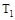 ,达到平衡时b、d点的反应速率为 ,达到平衡时b、d点的反应速率为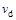 > >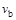 |
D.在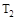 和 和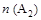 不变时达到平衡, 不变时达到平衡,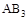 的物质的量大小为:c>b>a 的物质的量大小为:c>b>a |
在密闭容器中进行下列反应:M (g)+N (g)  R (g)+2 L此反应符合下面图像。下列叙述正确的是
R (g)+2 L此反应符合下面图像。下列叙述正确的是
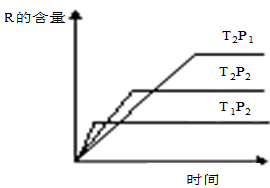
| A.正反应放热,L是气体 |
| B.正反应吸热,L是固体 |
| C.正反应吸热,L是气体 |
| D.正反应放热,L是液体 |
下列说法中有明显错误的是
| A.对有气体参加的化学反应,增大压强体系体积减小,可使单位体积内活化分子数增加,因而反应速率增大 |
| B.升高温度,一般可使活化分子的百分数增大,因而反应速率增大 |
| C.活化分子之间发生的碰撞一定为有效碰撞 |
| D.加入适宜的催化剂,可使活化分子的百分数大大增加,从而成千上万倍地增大化学反应的速率 |
I、某学生实验小组用50mL0.50mol•L—1的盐酸与50mL0.50mol•L—1的NaOH溶液在右图所示的装置中进行中和反应反应热的测定
(1)图中装置缺少的一种仪器,该仪器名称为 。

(2)将反应混合液的 温度记为反应的终止温度。
(3)下列说法正确的是
| A.小烧杯内残留有水,会使测得的反应热数值偏小 |
| B.可用相同浓度和体积的醋酸代替稀盐酸溶液进行实验 |
| C.烧杯间填满碎纸条的作用是固定小烧杯 |
| D.酸、碱混合时,应把量筒中的溶液缓缓倒入烧杯的溶液中,以防液体外溅 |
II、某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如下方案完成实验。
| 实验编号 |
反应物 |
催化剂 |
| ① |
10mL2% H2O2溶液 |
无 |
| ② |
10mL5% H2O2溶液 |
无 |
| ③ |
10mL5% H2O2溶液 |
1mL0.1mol·L-1FeCl3溶液 |
| ④ |
10mL5% H2O2溶液+少量HCl溶液 |
1mL0.1mol·L-1FeCl3溶液 |
| ⑤ |
10mL5% H2O2溶液+少量NaOH溶液 |
1mL0.1mol·L-1FeCl3溶液 |
(1)催化剂能加快化学反应速率的原因是__________________。
(2)实验①和②的目的是____________________________。实验时由于较长时间没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进是____________________。
(3)写出实验③的化学反应方程式 。
(4)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如下图。

分析上图能够得出的实验结论是_______________________。
1918年,Lewis提出反应速率的碰撞理论:反应物分子间的相互碰撞是反应进行的必要条件,但并不是每次碰撞都能引起反应,只有少数碰撞能发生化学反应。能引发化学反应的碰撞称之为有效碰撞。

(1)图I是HI分解反应中HI分子之间的几种碰撞示意图,其中属于有效碰撞的是_____________(选填“A”、“B”或“C”);
(2)图II是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,则写出该反应的热化学方程式_______________________
(3)E1的大小对该反应的反应热有无影响? 。(选填“有”或“无”)
(4)进一步研究表明,化学反应的能量变化(ΔH)与反应物和生成物的键能有关。键能可以简单的理解为断开1 mol 化学键时所需吸收的能量。下表是部分化学键的键能数据:
| 化学键 |
C-H |
Cl-Cl |
C—Cl |
H—Cl |
| 键能/ kJ·mol–1 |
X |
243 |
330 |
432 |
已知:反应CH4(g)+Cl2(g)=CH3Cl(g)+HCl(g);△H= -106kJ/mol,则上表中X= 。
(5)已知:① C(s)+O2(g)=CO2(g); DH=-393.5 kJ·mol-1
② 2CO(g)+O2(g)=2CO2(g); DH=-566 kJ·mol-1
③ TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g); DH=+141 kJ·mol-1
则TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的DH=____________________
反应3Fe(s)+4H2O(g)⇌Fe3O4(s)+4H2(g)在一体积可调的密闭容中进行,下列条件的改变对其反应速率几乎无影响的是
| A.增加Fe的表面积 |
| B.保持体积不变,充入Ne使体系压强增大 |
| C.将容器的体积缩小一半 |
| D.保持总压强不变,充入Ne使容器的体积增大 |
如图所示曲线表示其他条件一定时,反应:2NO+O2 2NO2 ΔH<0,NO的转化率与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)>v(逆)的点是
2NO2 ΔH<0,NO的转化率与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)>v(逆)的点是
| A.a点 | B.b点 |
| C.c点 | D.d点 |
羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡: CO(g)+H2S(g) COS(g)+H2(g) K=0.1反应前CO的物质的量为10mol,平衡后CO物质的量为8mol,下列说法正确的是
COS(g)+H2(g) K=0.1反应前CO的物质的量为10mol,平衡后CO物质的量为8mol,下列说法正确的是
| A.升高温度,H2S浓度增加,表明该反应是吸热反应 |
| B.通入CO后,正反应速率逐渐增大 |
| C.反应前H2S物质的量为7mol |
| D.CO的平衡转化率为80% |
下列说法不正确的是
| A.增大压强,活化分子百分数不变,化学反应速率增大 |
| B.升高温度,活化分子百分数增大,化学反应速率增大 |
| C.加入反应物,活化分子百分数增大,化学反应速率增大 |
| D.使用催化剂,活化分子百分数增大,化学反应速率增大 |
为探究足量锌与稀硫酸的反应速率(以v(H2)表示),向反应混合液中加入某些物质,下列判断正确的是
| A.加入NH4HSO4固体,v(H2)不变,生成H2量不变 |
| B.加入少量水,v(H2)减小,生成H2量减少 |
| C.加入CH3COONa固体,v(H2)减小,生成H2量不变 |
| D.滴加少量CuSO4溶液,v(H2)增大,生成H2量减少 |
已知反应:2NO2 (红棕色)  N2O4(无色) △H<0。将一定量的NO2充入注射器中后封口,下右图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是
N2O4(无色) △H<0。将一定量的NO2充入注射器中后封口,下右图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是

| A.b点的操作是拉伸注射器 |
| B.d 点:v(正) < v(逆) |
| C.c点与a点相比,c(NO2)增大,c(N2O4)减小 |
| D.若不忽略体系温度变化,且没有能量损失,则温度关系:T(b)>T(c) |
在恒容密闭容器中加入一定量的反应物后存在下列平衡:
CO(g)+H2O(g) CO2(g)+H2(g),平衡时CO2物质的量浓度与温度的关系如图所示,下列说法正确的是
CO2(g)+H2(g),平衡时CO2物质的量浓度与温度的关系如图所示,下列说法正确的是
A.该反应的DH <0
B.在T2时,D点的反应速率:ν(正)<(逆)
C.A、C两点相比,混合气体的平均相对分子质量:M(A) < M(C)
D.若T1、T2时的平衡常数分别为K1、K2,则K1>K2
下列四种NaHCO3溶液分别加入到四个盛有10mL 2 mol·L-1盐酸的烧杯中,均加水稀释到50mL,则反应最快的是
| A.10℃20mL 3 mol·L-1的NaHCO3溶液 | B.20℃30mL 2 mol·L-1的NaHCO3溶液 |
| C.20℃10mL 4 mol·L-1的NaHCO3溶液 | D.10℃10mL 2 mol·L-1的NaHCO3溶液 |
试题篮
()