在一定条件下,可逆反应A+B mC变化如图所示。已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,p为反应在T2温度时达到平衡后容器加压的变化情况,问:
mC变化如图所示。已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,p为反应在T2温度时达到平衡后容器加压的变化情况,问: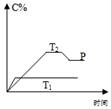
(1)温度T1 _____T2(填大于、等于或小于);
(2)正反应是__________反应(填“吸热”或“放热”);
(3)如果A、B、C均为气体,则m_____2(填大于、等于或小于);
(4)当温度和容积不变时,如向平衡体系中加入一定量的某稀有气体,则体系的压强_____(“增大”、“减小”或“不变”),平衡_______移动;当温度和压强不变时,如在平衡体系中加入一定量的某稀有气体,平衡_______移动(填“向正反应方向”“向逆反应方向”或“不”)。
已知2A2(g)+B2(g) 2C3(g) △H=" -a" kJ•mol-1(a>0),在一个有催化剂的固定容积的容器中加入2molA2和1molB2,在500℃时充分反应达到平衡后C3的浓度为w mol/L,放出热量b kJ;
2C3(g) △H=" -a" kJ•mol-1(a>0),在一个有催化剂的固定容积的容器中加入2molA2和1molB2,在500℃时充分反应达到平衡后C3的浓度为w mol/L,放出热量b kJ;
(1)比较a __________b( 填>、=、<);
(2)若将反应温度升高到700℃,反应的平衡常数将_________(增大、减小或不变);
(3)能说明该反应已经达到平衡状态的是______
a.V(C3)=2V(B2); b.容器内压强保持不变
c.V逆(A2)=2V正(B2) d.容器内的密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是_________
a.及时分离出C3气体; b.适当升高温度; c.增大B2的浓度; d.选择高效的催化剂
在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应X(g)+Y(g) 2Z(g) △H<0,一段时间后达到平衡。反应过程中测定的数据如下表:
2Z(g) △H<0,一段时间后达到平衡。反应过程中测定的数据如下表:
| t/min |
2 |
4 |
7 |
9 |
| n(Y)/mol |
0.12 |
0.11 |
0.10 |
0.10 |
下列说法正确的是( )
A.反应前2min的平均速率v(Z)=2.0×10-5mol/(L•min)
B.其他条件不变,降低温度,反应达到新平衡前v(逆)>v(正)
C.该温度下此反应的平衡常数K=1.44
D.其他条件不变,再充入0.2mol Z,平衡时X的体积分数增大
已知:2CH3OH(g) CH3OCH3(g)+H2O(g) △H=" -25" kJ•mol-1。某温度下的平衡常数为400。此温度下,在1L体积不变的密闭容器中加入CH3OH,某时刻测得各组分的物质的量浓度如下表,下列说法中不正确的是( )
CH3OCH3(g)+H2O(g) △H=" -25" kJ•mol-1。某温度下的平衡常数为400。此温度下,在1L体积不变的密闭容器中加入CH3OH,某时刻测得各组分的物质的量浓度如下表,下列说法中不正确的是( )
| 物质 |
CH3OH |
CH3OCH3 |
H2O |
| c/(mol•L-1) |
0.08 |
1.6 |
1.6 |
A.此时刻反应达到平衡状态
B.容器内压强不变时,说明反应达平衡状态
C.平衡时,再加入与起始等量的CH3OH,达新平衡后CH3OH转化率不变
D.平衡时,反应混合物的总能量降低40kJ
在容积一定的密闭容器中,置入一定量的NO(g)和足量C(s),发生反应C(s)+2NO(g) CO2(g)+N2(g),平衡状态时NO(g)的物质的量溶液c(NO)与温度T的关系如下图所示,则下列说法中,正确的是( )
CO2(g)+N2(g),平衡状态时NO(g)的物质的量溶液c(NO)与温度T的关系如下图所示,则下列说法中,正确的是( )
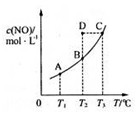
| A.该反应的△H>0 |
| B.若该反应在T1、T2时的平衡常数分别为K1、K2,则K1<K2 |
| C.在T2时,若反应体系处于状态D,则这时一定有v正<v负 |
| D.在T3时,若混合气体的密度不再变化,则可以判断反应达到平衡状态C |
某化学研究小组探究外界条件对化学反应mA(g)+nB(g) pC(g)的速率和平衡的影响图像如下,下列判断正确的是( )
pC(g)的速率和平衡的影响图像如下,下列判断正确的是( )
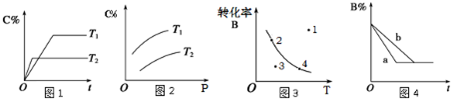
| A.由图1可知,T1<T2,该反应正反应为吸热反应 |
| B.由图2可知,该反应m+n<p |
| C.图3中,表示反应速率v正>v逆的是点3 |
| D.图4中,若m+n=p,则a曲线一定使用了催化剂 |
在一密闭容器中充入1 mol H2和1 mol I2,压强为p(Pa),并在一定温度下使其发生反应:H2(g)+I2(g)=2HI(g)ΔH<0。
(1)保持容器容积不变,向其中加入1 mol H2,反应速率加快吗? 理由是 。
(2)保持容器容积不变,向其中加入1 mol N2(N2不参加反应),反应速率也加快吗? 理由是 。
(3)保持容器内气体压强不变,向其中加入1 mol N2(N2不参加反应),反应速率 ,理由是 。
(4)保持容器内气体压强不变,向其中加入1 mol H2(g)和1 mol I2(g),反应速率 ,理由是 。
(5)提高起始的反应温度,反应速率 ,理由是 。
下列说法正确的是( )
| A.自发反应在任何条件下都能实现 |
| B.化学反应不一定都有能量变化 |
| C.升高温度,活化分子百分数增大,化学反应速率一定增大 |
| D.一般使用催化剂可以降低反应的活化能,增大活化分子百分数,从而提高反应物的转化率 |
高温下,某可逆反应达到平衡,其平衡常数为K= ,恒容时,升高温度,H2的浓度减小,则下列说法正确的是( )
,恒容时,升高温度,H2的浓度减小,则下列说法正确的是( )
| A.该反应的焓变为正值 |
| B.升高温度,K值减小 |
| C.升高温度,逆反应速率减小 |
D.该反应的化学方程式为CO(g)+H2O(g) CO2(g)+H2(g) CO2(g)+H2(g) |
可使C(s)+ CO2(g)=2CO(g)反应速率增大的措施是( )
①增大压强 ②增加炭的量 ③通入CO2
④恒压下充入N2 ⑤恒容下充入N2 ⑥升温
| A.①③④ | B.②④⑥ | C.①③⑥ | D.③⑤⑥ |
已知反应:2CH3COCH3(l)⇌CH3COCH2COH(CH3)2(l).取等量CH3COCH3,分别在0℃和20℃下,测得其转化分数随时间变化的关系曲线(Y﹣t)如图所示.下列说法正确的是( )

| A.b代表0℃下CH3COCH3的Y﹣t曲线 |
B.反应进行到20min末,CH3COCH3的 |
| C.升高温度可缩短反应达平衡的时间并能提高平衡转化率 |
D.从Y=0到Y=0.113,CH3COCH2COH(CH3)2的 |
100mL浓度为2mol/L的盐酸跟略过量的锌片反应,为减慢反应速率,又不影响生成氢气的总量,可采用的方法是( )
| A.加入适量的6mol/L的盐酸 | B.加入数滴氯化铜溶液 |
| C.加入适量醋酸钠溶液 | D.加入适量的NaOH固体 |
试题篮
()