设C+CO2  2CO(正反应为吸热反应),反应速率为v1;N2+3H2
2CO(正反应为吸热反应),反应速率为v1;N2+3H2  2NH3(正反应为放热反应),反应速率为v2,对于上述反应,当温度升高时,v1和v2的变化情况为
2NH3(正反应为放热反应),反应速率为v2,对于上述反应,当温度升高时,v1和v2的变化情况为
| A.同时增大 | B.同时减小 |
| C.v1增大,v2减小 | D.v1减小,v2增大 |
对于工业合成氨反应:N2+3H2 2NH3,下列说法错误的是
2NH3,下列说法错误的是
| A.使用合适的催化剂可以加大反应速率 |
| B.升高温度可以增大反应速率 |
| C.增大N2浓度可以使H2转化率达到100℅ |
| D.增大N2浓度可以增大反应速率 |
下列说法不正确的是
| A.探究温度对反应速率影响时,分别水浴加热硫代硫酸钠溶液、硫酸溶液到一定温度,再将两溶液混合 |
| B.用简易量热计测定反应热,使用碎泡沫隔热保温、环形玻璃搅拌棒搅拌、量取达到的最高温度,计算反应热,取2~3 次的实验平均值 |
| C.H2O2在过氧化氢酶的催化下,随着温度的升高,分解速率持续加快 |
| D.欲粗略测定某未知浓度的醋酸溶液中醋酸的电离常数Ka,应做的实验和所需的试剂(或试纸)分别为中和滴定实验和pH试纸 |
下列说法正确的是
| A.增大反应物浓度,可增大单位体积内活化分子的百分数,从而增大有效碰撞的次数 |
| B.有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大 |
| C.升高温度能使化学反应速率增大,主要原因是增加了反应物分子中活化分子的百分数 |
| D.催化剂不影响反应活化能但能增大单位体积内活化分子的百分数,从而增大反应速率 |
工业合成氨是人工固氮方法之一。
I.已知下列物质的键能:

则N2(g)+3H2(g)=2NH3(g) △H=_____________。
Ⅱ.恒温下,将一定量N2、H2置于10L的容器中发生反应,反应过程中各物质浓度随时间变化如下图。
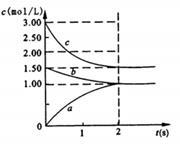
(1)图中0~2s内的反应速率v(H2)= ;该温度下平衡常数的计算表达式为__________。
(2)该反应达到平衡的标志为 (填序号)。
| A.混合气体的平均相对分子质量不变 |
| B.物质的量浓度比等于系数比 |
| C.容器内温度不变 |
| D.断裂1moIH-H键同时断裂2molN-H键 |
(3)若其它条件不变,将恒容条件变为恒压,则平衡时c(N2) (填“增大”、“减小”、“不变’’或“不能确定”)。
(4)哈伯研究所因证实N2、H2在固体催化剂(Fe)表面吸附和解吸以合成氨的过程而获诺贝尔奖。若用 分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用下图表示:
分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用下图表示:

①吸附后,能量状态最低的是 (填字母序号)。
②由上述原理,在铁表面进行NH3的分解实验,发现分解速率与浓度关系如图。从吸附和解吸过程分析,c0前速率增加的原因可能是 ;c0后速率降低的原因可能是 。

下列叙述正确的是
| A.升高温度和增大浓度都会加快反应速率,其原因是增加了活化分子的百分率 |
| B.常温下,pH=1的水溶液中,Na+、NO3-、HCO3-、Fe2+可以大量共存 |
C.NaHS的电离方程式为:NaHS Na++HS— Na++HS— |
| D.C(石墨,s)=C(金刚石,s);△H>0,所以石墨比金刚石稳定 |
下列图示与对应的叙述相符的是
A.图I表示H2与O2发生反应过程中的能量变化,则H2的燃烧热△H =" -" 241.8 kJ.mol-1
B.图Ⅱ表示某可逆反应正、逆反应速率随温度的变化,则该反应的正反应是放热反应
C.图Ⅲ表示0.1 mol MgCl2.6H2O在空气中充分加热时固体质量随时间的变化
D.图Ⅳ表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则NaA溶液的pH大于同浓度NaB溶液的pH
对于硫酸工业中SO2的催化氧化反应 2SO2+O2 2SO3,下列说法错误的是
2SO3,下列说法错误的是
| A.使用催化剂能加快化学反应速率 |
| B.增大O2浓度可以使SO2转化率达到100% |
| C.降低反应温度,化学反应速率减慢 |
| D.增大O2浓度,化学反应速率增大 |
一定量的盐酸跟过量的铁粉反应时,为了减缓反应速率,且不影响生成氢气的总量,可向盐酸中加入适量的
| A.NaOH(固体) | B.KNO3 |
| C.HCl | D.CH3COONa(固体) |
在气体反应中,能使反应物活化分子数和活化分子百分数同时增加的方法是①增加反应物的浓度 ②升高温度 ③移去生成物 ④增大压强 ⑤加入催化剂
| A.①③ | B.①⑤ | C.②⑤ | D.②④ |
某研究小组利用“钯催化交叉偶联反应”合成了有机物丙,合成路线如下:
下列分析判断正确的是
| A.分离提纯有机物丙宜在NaOH热溶液中进行 |
| B.PbCl2的作用是提高反应物的活性,加快反应速率 |
| C.可用酸性KMnO4溶液检验有机物丙中是否含有机物乙 |
| D.利用NaOH溶液、AgNO3溶液即可确定有机物甲中含有溴元素 |
一定量的盐酸跟过量的铁粉反应时,为了减缓反应速率,且不影响生成氢气的总量可向盐酸中加入适量的
| A.NaOH固体 | B.同浓度的醋酸溶液 | C.NH4Cl固体 | D.CH3COONa固体 |
根据下列有关实验得出的结论一定正确的是
| 选项 |
方法 |
结论 |
| A |
实验室制氢气,向稀H2SO4中滴加少量Cu(NO3)2溶液 |
可以加快制备氢气的反应速率 |
| B |
向Fe(NO3)2溶液中滴入用硫酸酸化的H2O2溶液, 则溶液变黄 |
氧化性:H2O2>Fe3+ |
| C |
相同温度下,等质量的大理石与等体积、等浓度的盐酸反应 |
反应速率: 粉状大理石>块状大理石 |
| D |
吸热反应“TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g)”在一定条件下可自发进行 |
则该反应的△S<0 |
试题篮
()