一定温度下,取pH=12的NaOH溶液和氨水各10 mL,分别用蒸馏水冲稀至1 L。关于稀释后的溶液的pH的说法正确的是
| A.NaOH溶液的pH小于氨水的pH | B.NaOH溶液的pH大于氨水的pH |
| C.两溶液的pH相等 | D.无法判别两溶液pH的相对大小 |
在C(s)+CO2(g)  2CO(g)反应可使反应速率增大的措施是
2CO(g)反应可使反应速率增大的措施是
①增大压强 ②增加碳的量 ③通入CO2 ④恒压下充入N2 ⑤恒容下充入N2
| A.①③⑤ | B.②④ | C.①③ | D.③⑤ |
在生产、生活中为增大反应速率而采取的措施合理的是
| A.食物放在冰箱中 |
| B.塑料制品中添加抑制剂 |
| C.在糕点包装内放置小包除氧剂 |
| D.燃煤发电时用煤粉代替煤块 |
在体积均为1.0L的量恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1molCO2和0.2molCO2,在不同温度下反应CO2(g)+c(s) 2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是
2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是
A.反应CO2(g)+c(s) 2CO(g) △S>0、△H<0 2CO(g) △S>0、△H<0 |
| B.体系的总压强P总:P总(状态Ⅱ)<2P总(状态Ⅰ) |
| C.逆反应速率V逆:V逆(状态Ⅰ)>V逆(状态Ⅲ) |
| D.体系中c(CO):c(CO,状态Ⅱ)<2c(CO,状态Ⅲ) |
一定量的盐酸跟过量的铁粉反应时,为了减缓反应速率,且不影响生成氢气的总量,可向盐酸中加入适量的
①NaOH固体 ②H2O ③NH4Cl固体 ④CH3COONa固体 ⑤NaNO3固体 ⑥KCl溶液
| A.②④⑥ | B.①② | C.②③⑤ | D.②④⑤⑥ |
(1)如果反应物所具有的总能量大于生成物所具有的总能量,反应物转化为生成物时 (填吸收或放出)热量,△ H (填大于或小于)0;
(2)对于反应2SO2 + O2 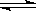 2SO3 其它条件不变,只改变一个反应条件,将生成SO3的反应速率的变化填入表中空格里 。(填字母 A.增大 B.减小 C.不变)
2SO3 其它条件不变,只改变一个反应条件,将生成SO3的反应速率的变化填入表中空格里 。(填字母 A.增大 B.减小 C.不变)
| 改变条件 |
速率变化 |
||
| 降低温度 |
|
||
| 增大O2的浓度 |
|
||
| 使用V2O5做催化剂 |
|
||
| 压缩气体 |
|
用3g块状大理石与30mL3mol/L盐酸反应制取CO2气体,若要增大反应速率,可采取的措施是: ①再加入30mL3mol/L盐酸;②改用30mL6mol/L盐酸;③改用3g粉末状大理石;④适当升高温度
| A.①②④ | B.②③④ | C.①③④ | D.①②③ |
在恒温条件下,能使 A(g)+ B(g)  C(g) + D(g)正反应速率增大的措施是
C(g) + D(g)正反应速率增大的措施是
| A.减小C 或D 的浓度 | B.增大压强 |
| C.减小B 的浓度 | D.增大 A 或B的浓度 |
10 mol浓度为1mol•L-1的盐酸与过量的锌粉反应,若加入适量的下列溶液,能减慢反应速率但又不影响氢气的生成的是
| A.NaHCO3 | B.CH3COONa | C.CuSO4 | D.Na2CO3 |
升高温度能使反应速率加快,下列叙述正确的是( )
| A.降低反应所需的活化能 |
| B.使反应体系的活化分子百分数增大 |
| C.体系中活化分子总数不变 |
| D.对于吸热反应、放热反应,反应速率同等程度加大 |
某反应的△H=+100kJ/mol,下列有关该反应的叙述正确的是
| A.正反应活化能小于100kJ•mol-1 |
| B.正反应活化能不小于100kJ•mol-1 |
| C.正反应活化能比逆反应活化能大100kJ•mol-1 |
| D.逆反应活化能一定小于100kJ•mol-1 |
下列说法正确的是
| A.活化分子碰撞即发生有效碰撞 |
| B.升高温度会加快反应速率,原因是增加了活化分子的碰撞次数 |
| C.某一反应的活化分子百分数是个定值 |
| D.活化分子的碰撞不一定是有效碰撞 |
试题篮
()