10ml浓度为1mol/L的盐酸与过量的锌粉反应,若加入适量的下列溶液,能减慢反应速率但又不影响氢气生成的是
| A.K2SO4 | B.CH3COONa | C.CuSO4 | D.Na2CO3 |
某反应的△H=+100kJ/mol,下列有关该反应的叙述正确的是
| A.正反应活化能小于100kJ•mol-1 |
| B.正反应活化能不小于100kJ•mol-1 |
| C.正反应活化能比逆反应活化能大100kJ•mol-1 |
| D.逆反应活化能一定小于100kJ•mol-1 |
把铝条放入盛有过量稀盐酸的试管中,不影响氢气产生速率的因素是
| A.盐酸的浓度 | B.铝条的表面积 | C.溶液的温度 | D.加少量Na2SO4固体 |
改变外界条件可以影响化学反应速率,针对H2(g)+I2(g) 2HI(g),其中能使活化分子百分数增加的是
2HI(g),其中能使活化分子百分数增加的是
①增加反应物浓度 ②增大气体的压强 ③升高体系的温度 ④使用催化剂
| A.①② | B.②③ | C.①④ | D.③④ |
决定化学反应速率的主要因素是
| A.催化剂 | B.参加反应的物质本身的性质 |
| C.反应物的浓度 | D.温度、压强以及反应物的接触面 |
为了制取碘,可通过反应:2NO+O2==2NO2 NO2+2H+ +2I- ="=NO" + I2+H2O制得,NO在制碘过程中的作用是
| A.还原剂 | B.氧化剂 | C.催化剂 | D.反应物 |
对于反应 A + B 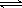 C,下列条件的改变一定能使化学反应加快的是
C,下列条件的改变一定能使化学反应加快的是
| A.升高体系的温度 | B.增加A的物质的量 |
| C.减少C的物质的量 | D.增大体系的压强 |
下列说法正确的是
| A.活化分子碰撞即发生有效碰撞 |
| B.升高温度会加快反应速率,原因是增加了活化分子的碰撞次数 |
| C.某一反应的活化分子百分数是个定值 |
| D.活化分子的碰撞不一定是有效碰撞 |
对于反应N2+3H2 2NH3(正反应为放热反应),能使正反应速率和逆反应速率增大的因素有:①升高温度、②使用催化剂、③增大压强、④增加N2或和H2的浓度
2NH3(正反应为放热反应),能使正反应速率和逆反应速率增大的因素有:①升高温度、②使用催化剂、③增大压强、④增加N2或和H2的浓度
| A.①②③ | B.②③④ | C.①②③④ | D.①③④ |
相同质量的锌与酸反应制备H2,欲使反应速率最大,下列条件下的最佳组合是
①纯锌片②粗锌粒③0.1mol·L-1硫酸④98%的浓硫酸⑤加热⑥用冰水冷却
| A.①④⑤ | B.②③⑤ | C.①③⑥ | D.②④⑤ |
试题篮
()