某温度时,AgCl(s)  Ag+(aq)+Cl-(aq)在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是
Ag+(aq)+Cl-(aq)在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是
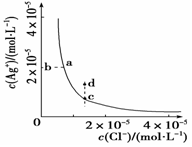
| A.加入AgNO3,可以使溶液由c点变到d点 |
| B.加入少量水,平衡右移,Cl-浓度减小 |
| C.d点没有AgCl沉淀生成 |
| D.c点对应的Ksp等于a点对应的Ksp |
当固体AgCl放在较浓的KI溶液中振荡时,则部分AgCl转化为AgI,原因是
| A.AgI比AgCl稳定 | B.碘氧化性比氯弱 |
| C.I-的还原性比Cl-强 | D.溶解度AgI<AgCl |

 已知:Ksp(AgCl)=1.8×10—10,Ksp(AgI)=1.5×10—16 ,Ksp(AgBr)=7.7×10—13,则下列难溶盐的饱和溶液中, Ag+浓度大小顺序正确的是
已知:Ksp(AgCl)=1.8×10—10,Ksp(AgI)=1.5×10—16 ,Ksp(AgBr)=7.7×10—13,则下列难溶盐的饱和溶液中, Ag+浓度大小顺序正确的是
| A.AgCl>AgI> AgBr | B.AgCl> AgBr>AgI |
| C.AgBr >AgCl>AgI | D.AgBr >AgI>AgCl |
铁及其化合物与生活密切相关,古代炼丹家以绿矾(FeSO4·7H2O为原料,放在炼丹炉中锻烧可制得绿矾油。绿矾油是一种无色粘稠液体,可用于除掉兵器上的铁锈。右图是2. 78 g绿矾隔绝空气受热分解时,所得固体产物的质量随温度变化的曲线。将加热产生的所有气体通入足量的BaCl2溶液.得自色沉淀1.16g。


(1)绿矾油主要成份的化学式为 。t1~t2.发生反应的化学方程式为 。
(2)若将28.8 g草酸亚铁(FeC2O4)隔绝空气加热至100℃,得到14.4 g黑色细粉,则可推知该黑色细粉为 。
(3)以下是FeSO4·7H2O的实验室制备流理图

根据题意完成下列填空:
①反应II需要100 mL1. 5 mol·L-1的稀H2SO4溶解洁净的铁屑,用质量分数为98%、密度为1. 84 g·cm -3的浓H2SO4配制。所用的仪器有量筒、烧杯、玻璃捧、胶头滴管及 。
②操作A的名称为 。
③测定FeSO4·7H2O产品中Fe2+含量的常用方法是KMnO4溶液滴定法。已知称取6.0 g FeSO4·7H2O产品,配制成溶液,用硫酸酸化的0.2000 mol·L -1KMnO4溶液滴定,消耗KMnO4溶液的体积为20. 00 mL。发生反应的离子方程式为 ,计算上述样品中FeSO4·7H2O的质量分数为 (保留两位有效数字)。
下列说法中,正确的是
| A.难溶电解质在水溶液中达到沉淀溶解平衡时,沉淀和溶解即停止 |
| B.Ksp越小,难溶电解质在水中的溶解能力一定越弱 |
| C.Ksp的大小与离子浓度无关,只与难溶电解质的性质和温度有关 |
| D.相同温度下,AgCl在水中的溶解能力与在NaCl溶液中的相同 |
下列溶液中各离子的浓度关系正确的是
| A.0.1 mol·L-1 CH3COONa溶液中:c(CH3COO-)+c(CH3COOH)="0.1" mol·L-1 |
| B.25℃时,等物质的量浓度的各溶液pH关系为:pH(Na2CO3)>pH(C6H5ONa)>pH(NaHCO3)>pH(CH3COONa) |
| C.25℃时,pH=9.4、浓度均为0.1 mol·L-1的HCN与NaCN的混合溶液中:c(Na+)>c(HCN)>c(CN-)>c(OH-) |
| D.将足量AgCl分别放入:①5m水,②10mL0.2mol/LMgC12,③20mL0.3mol/L盐酸中溶解至饱和,c(Ag+):①>②>③ |
已知25 ℃物质的溶度积常数为:FeS:Ksp=6.3×10-18;CuS:Ksp=1.3×10-36;ZnS:Ksp=1.6×10-24。下列说法正确的是
| A.相同温度下,CuS的溶解度大于ZnS的溶解度 |
| B.除去工业废水中的Cu2+,可以选用FeS做沉淀剂 |
| C.足量CuSO4溶解在0.1 mol/L的H2S溶液中,Cu2+能达到的最大浓度为1.3×10-35 mol/L |
| D.在ZnS的饱和溶液中,加入FeCl2溶液,一定不产生FeS沉淀 |
饱和石灰水中存在溶解平衡:Ca(OH)2(s) Ca2+(aq)+2OH-(aq),向其中加入少量生石灰,充分反应后恢复至原温度,则下列说法中不正确的是( )
Ca2+(aq)+2OH-(aq),向其中加入少量生石灰,充分反应后恢复至原温度,则下列说法中不正确的是( )
| A.溶液的pH不变 | B.溶液中Ca2+的浓度减小 |
| C.溶液中OH-的数目减小 | D.容器中固体的质量增加 |
用
滴定
溶液的滴定曲线如图所示。下列有关描述错误的是( )

| A. | 根据曲线数据计算可知 的数量级为 |
B. | 曲线上各点的溶液满足关系式 |
| C. | 相同实验条件下,若改为 , 反应终点c移到a |
D. | 相同实验条件下,若改为 , 反应终点c向b方向移动 |
已知:Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.5×10-16 ,Ksp(AgBr)=7.7×10-13,则下列难溶盐的饱和溶液中,Ag+浓度大小顺序正确的是
| A.AgCl>AgI> AgBr | B.AgBr >AgI>AgCl |
| C.AgBr >AgCl>AgI | D.AgCl> AgBr>AgI |
常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水中的沉淀溶解平衡曲线见图。下列叙述正确的是( )
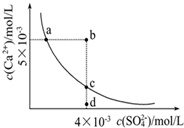
①a、c两点均可以表示CaSO4溶于水所形成的饱和溶液;②a点对应的Ksp不等于c点对应的Ksp;③b点对应的溶液将有沉淀生成;④向d点溶液加入适量的CaCl2固体可以变到c点;⑤d点溶液通过蒸发溶剂可以变到c点;⑥常温下CaSO4溶于水的饱和溶液中,c(Ca2+)与c(SO42-)的乘积对应曲线上任意一点;⑦常温下,向100mL饱和CaSO4溶液中加入400mL0.01mol/L Na2SO4溶液,能使溶液由a点变为b点
| A.2句 | B.3句 | C.4句 | D.5句 |
向盛有0.1mol/LAgNO3溶液的试管中滴加 0.05mol/LNa2S溶液至沉淀完全,再向上层清液中滴加足量 NaCl,产生的现象及发生的反应是
| A.黑色沉淀完全转化为白色沉淀 | B.既有Ag2S也有 AgCl |
| C.不能由黑色沉淀转变为白色沉淀 | D.只有 AgCl白色沉淀 |
下列叙述或表示正确的是( )
| A.0.1mol·L﹣1的醋酸的pH=a,0.01mol·L﹣1的醋酸的pH=b,则a+1=b |
| B.常温下0.1mol·L﹣1的醋酸溶液与等浓度等体积NaOH溶液反应后的溶液中:c(CH3COOH)+c(CH3COO﹣)=0.1mol·L﹣1 |
| C.难溶电解质AB2的饱和溶液中,已知:c(A2+)="x" mol·L﹣1,c(B﹣)="y" mol·L﹣1,则Ksp值为4xy2 |
| D.用200mL4mol·L﹣1的NaOH溶液将0.6mol CO2完全吸收,反应的离子方程式为: 3CO2+4OH﹣=CO32﹣+2HCO3﹣+H2O |
已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.0×10-16。下列说法错误的是( )
| A.AgCl不溶于水,不能转化为AgI |
| B.在含有浓度均为0.001 mol·L-1的Cl-、I-的溶液中缓慢加入AgNO3稀溶液,首先析出AgI沉淀 |
| C.AgI比AgCl更难溶于水,所以,AgCl可以转化为AgI |
D.常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于 ×10-11mol·L-1 ×10-11mol·L-1 |
试题篮
()