化学与社会、生活密切相关。对下列现象或事实的解释正确的是
| 选项 |
现象或事实 |
解释 |
| A. |
铝制餐具不宜长时间存放酸性、碱性和咸的食物 |
铝能与食物中的酸、碱和盐反应 |
| B. |
伤口消毒常应用75%的酒精而不是95% |
75%的酒精其氧化性要强于95% |
| C. |
工业上用MnO2制取MnCl2时,用MnS除去溶液中含有的Cd2+等金属离子 |
Ksp(MnS)>Ksp(CdS) |
| D. |
洁厕灵不能与“84”消毒液混用 |
两种溶液混合产生的HClO易分解 |
部分弱电解质的电离平衡常数如下表:
| 弱电解质 |
HCOOH |
HCN |
H2CO3 |
NH3·H2O |
| 电离平衡常数 (25 ℃) |
Ka=1.8×10-4 |
Ka=4.9×10-10 |
Ka1=4.3×10-7 Ka2=5.6×10-11 |
Kb=1.8×10-5 |
下列说法不正确的是
A.结合H+的能力:CO32->CN->HCO3->HCOO-
B.0.1mol/L的HCOONH4溶液中:c(HCOO-)>c(NH4+)>c(H+)>c(OH-)
C.25 ℃时,pH=3的盐酸与pH=11的氨水混合,若溶液显中性,则二者消耗的体积是:V(盐酸)>V(氨水)
D.HCN + HCOONa = NaCN + HCOOH
有关AgCl沉淀的溶解平衡说法正确的是
| A.此时,AgCl沉淀溶解速率为零 |
| B.AgCl难溶于水,溶液中没有Ag+ 和Cl— |
| C.升高温度,AgCl沉淀的溶解度增大 |
| D.向AgCl沉淀中加入NaCl固体,AgCl沉淀的溶解度不变 |
向NaOH溶液中缓慢通入CO2气体,溶液中CO32-的物质的量与通入CO2物质的量的关系图如下。下列关于图中a、b两点溶液的说法错误的是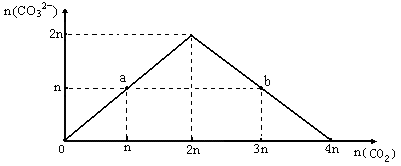
| A.a、b溶液与同浓度盐酸完全反应时,消耗盐酸的体积相同 |
| B.a溶液中水的电离程度与b溶液中水的电离程度相同 |
| C.a、b两溶液都满足:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-) +c(OH-) |
| D.将a、b两点混合后溶液满足:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3) |
16.下列说法正确的是
| A.实验室从海带中提取单质碘的方法是:取样、灼烧、溶解、过滤、萃取 |
| B.用乙醇和浓硫酸制备乙烯时,可用水浴加热控制反应的温度 |
| C.在室温下,向氯化银的沉淀溶解平衡体系中加入蒸馏水,氯化银的Ksp保持不变 |
| D.将(NH4)2 SO4溶液、CuSO4溶液分别加入蛋白质溶液中,都出现沉淀,表明二者均可使蛋白质变性 |
现有含MgCl2、AlCl3均为n mol的混合溶液,向其中滴NaOH溶液至过量。加入NaOH溶液的物质的量与生成沉淀的物质的量的关系正确的是(离子形成沉淀或沉淀的溶解与溶液pH的关系如下表)
| 离子 |
Mg2+ |
Al3+ |
物质 |
Al(OH)3 |
| 开始沉淀时的pH |
8.93 |
3.56 |
开始溶解时的pH |
8.04 |
| 完全沉淀时的pH |
10.92 |
4.89 |
完全溶解时的pH |
12.04 |

下列对沉淀溶解平衡的描述正确的是
A.Ksp(AB2)小于Ksp(CD),则AB2的溶解度大于CD的溶解度
B.沉淀溶解达到平衡时,沉淀的速率和溶解的速率相等
C.在氯化银的沉淀溶解平衡体系中,加入蒸馏水,氯化银的Ksp增大
D.沉淀溶解达到平衡时,如果再加入难溶性的该沉淀物,将促进溶解
已知氧化性:HClO>Cl2>Fe3+>SO42-;常温下,电离常数:K(H2CO3)>K(HClO)>K(HCO3-)>K[Al(OH)3];则下列相关离子方程式正确的是
| A.0.5mol/L的NaHSO3溶液与1.0mol/L的NaClO溶液等体积混合: HSO3-+ClO-=SO42-+Cl-+H+ |
| B.小苏打溶液与偏铝酸钠溶液混合:HCO3-+AlO2-+H2O=Al(OH)3↓+CO32- |
| C.“84”消毒液(主要成分为NaClO)露置在空气中变质: 2ClO-+CO2+H2O=CO32-+2HClO |
| D.在“84”消毒液中滴加FeSO4溶液:2Fe2++ClO-+H2O=2Fe3++Cl-+2OH- |
下列有关说法正确的是
| A.因为合金在潮湿的空气中易形成原电池,所以合金耐腐蚀性都较差 |
| B.常温下,MgO(s)+C(s)=Mg(s)+CO(g)不能自发进行,则其△H>0 |
| C.在NaCl和KBr的混合溶液中滴加AgNO3溶液,一定先产生淡黄色沉淀 |
| D.加热0.1 mol·L-1Al2(SO4)3溶液,水解程度增大、溶液的酸性增强 |
下列对沉淀溶解平衡的描述正确的是
| A.反应开始时溶液中个离子浓度相等 |
| B.沉淀溶解达到平衡时,如果再加入难溶性的该沉淀物,将促进溶解 |
| C.沉淀溶解达到平衡时,溶液中溶质的离子浓度相等,且保持不变 |
| D.沉淀溶解达到平衡时,沉淀的速率和溶解的速率相等 |
25℃时,水的电离达到平衡:H2O H+ + OH-,下列叙述正确的是
H+ + OH-,下列叙述正确的是
| A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低 |
| B.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低 |
| C.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变 |
| D.将水加热,Kw增大,pH不变 |
已知t ℃时的Ksp (AgC1) =1.6×10-10,Ksp (AgBr )=7.8×10-13;在t℃时,Ag2CrO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是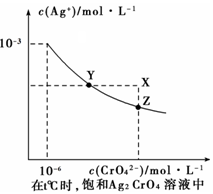
| A.t℃时,Ksp (Ag2CrO4 )=1×10-9 |
| B.t℃时,在饱和Ag2CrO4溶液中加入AgNO3可使溶液由Z点到X点 |
| C.t℃时,溶解度的大小顺序为AgC1 > Ag2CrO4>AgBr |
| D.t℃时,取一定量的KCl和KBr的混和溶液,向其中滴加AgNO3溶液,当AgCl开始沉淀时,c(C1-)/c(Br-)= Ksp (AgC1)/ Ksp (AgBr) |
下列说法不正确的是( )
| A.Ksp只与难溶电解质的性质和温度有关 |
| B.由于Ksp(ZnS)>Ksp(CuS),所以ZnS沉淀在一定条件下可转化为CuS沉淀 |
| C.其他条件不变,离子浓度改变时,Ksp不变 |
| D.两种难溶电解质作比较时,Ksp小的,溶解度一定小 |
某温度时,BaSO4在水中的沉淀溶解平衡曲线如下图所示。下列说法正确的是( )

提示:BaSO4(s) Ba2+(aq)+SO42-(aq)的平衡常数Ksp=c(Ba2+)·c(SO42-),称为溶度积常数。
Ba2+(aq)+SO42-(aq)的平衡常数Ksp=c(Ba2+)·c(SO42-),称为溶度积常数。
| A.加入Na2SO4可以使溶液由a点变到b点 |
| B.通过蒸发可以使溶液由d点变到c点 |
| C.d点无BaSO4沉淀生成 |
| D.a点对应的Ksp大于c点对应的Ksp |
下列说法不正确的是
| A.化学反应是旧键断裂和新键形成的过程 |
| B.盖斯定律实质上是能量守恒定律的体现 |
| C.反应前后分子数不变遵循的是质量守恒定律 |
| D.溶解平衡、水解平衡和电离平衡均为动态平衡 |
试题篮
()