已知:Ksp(AgCl)=1.8×10-10,Ksp(AgBr)=7.8×10-13。现将AgCl与AgBr的饱和溶液等体积混合,再加入足量浓AgNO3溶液,发生的反应为
| A.只有AgBr沉淀 |
| B.AgCl和AgBr沉淀等量生成 |
| C.AgCl和AgBr沉淀都有,AgCl沉淀比AgBr多 |
| D.AgCl和AgBr沉淀都有,AgBr沉淀比AgBr多 |
下列说法中正确的是
| A.饱和石灰水中加入一定量生石灰,温度明显升高,所得溶液的pH增大 |
B.AgCl悬浊液中存在平衡:AgCl(s)  Ag+(aq)+Cl-(aq),往其中加入少量NaCl粉末,平衡向左移动,溶液中离子的总浓度会减小 Ag+(aq)+Cl-(aq),往其中加入少量NaCl粉末,平衡向左移动,溶液中离子的总浓度会减小 |
| C.为减小洗涤过程中固体的损失,最好选用稀H2SO4代替H2O来洗涤BaSO4沉淀 |
| D.硬水中含有较多的Ca2+、Mg2+、HCO3-、SO42-,加热煮沸可以完全除去其中的 Ca2+、Mg2+ |
在重铬酸钾(K2Cr2O7)溶液中存在如下平衡:

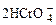

 , 向K2Cr2O7溶液中加入AgNO3溶液,发生离子交换反应,生成砖红色沉淀且溶液的pH下降,则生成的砖红色沉淀为
, 向K2Cr2O7溶液中加入AgNO3溶液,发生离子交换反应,生成砖红色沉淀且溶液的pH下降,则生成的砖红色沉淀为
| A.Ag2O | B.Ag2CrO4 | C.AgHCrO4 | D.Ag2Cr2O7 |
把Ca(OH)2放入蒸馏水中,一段时间后达到平衡:Ca(OH)2(s)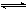 Ca2++2OH-
Ca2++2OH-
当向悬浊液中加入少量生石灰后,若温度保持不变,下列说法正确的是( )
| A.溶液中Ca2+数目增多 | B.溶液中Ca2+数目不变 |
| C.c(Ca2+)增大 | D.c(Ca2+)不变 |
下列说法正确的是
| A.AgCl的水溶液中,Ag+和Cl-浓度的乘积是一个常数; |
| B.AgCl的Ksp=1.8×10-10,在任何含AgCl固体的溶液中,c(Ag+)=c(Cl-)且Ag+与Cl-浓度的乘积等于1.8×10-10; |
| C.温度一定时,当溶液中Ag+和Cl-浓度的乘积等于Ksp值时,此溶液为AgCl的饱和溶液; |
| D.向饱和AgCl水溶液中加入盐酸,Ksp值变大。 |
常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水中的沉淀溶解平衡曲线见图。
下列说法正确的是
| A.CaSO4在稀硫酸中的溶解性比在纯水中的溶解性强 |
| B.b点将有沉淀生成,平衡后溶液中c(SO42-)一定等于3×10-3 mol/L |
C.d点溶液通过蒸发 可以变到c点 可以变到c点 |
| D.a点对应的Ksp等于c点对应的Ksp |
已知在25℃时,FeS、CuS的溶度积常数(Ksp)分别为6.3×10-18、1.3×10-36.常温时下列有关说法正确的是
| A.向H2S的饱和溶液中通入少量SO2气体溶液的酸性增强 |
| B.将足量的CuSO4溶解在0.1 mol/L的H2S溶液中,溶液中Cu2+的最大浓度为1.3×10-35 mol/L |
| C.因为H2SO4是强酸,所以反应:CuSO4+H2S===CuS↓+H2SO4不能发生 |
| D.除去工业废水中的Cu2+可以选用FeS作沉淀剂 |
下列对各种平衡体系的叙述中,完全正确的是一组是 ( )
①醋酸溶液中存在的电离平衡:CH3COOH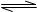 CH3COO-+H+,加水稀释后,溶液中所有离子浓度均减小;
CH3COO-+H+,加水稀释后,溶液中所有离子浓度均减小;
②常温下,在醋酸溶液中加入少量的CH3COONa固体,会使其电离平衡逆向移动;
③某温度下,容积一定的密闭容器中进行可逆反应:X(g)+Y(g)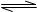 2Z(g)+W(s); △H>0平衡后,升高温度,该化学平衡正向移动;
2Z(g)+W(s); △H>0平衡后,升高温度,该化学平衡正向移动;
④在上述③的可逆反应中,当容器中气体压强不变时,反应达到平衡;
⑤一定浓度的醋酸钠溶液可使酚酞试液变红,其原因是溶液中存在如下平衡:
CH3COO-+H2O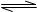 CH3COOH+OH-使得溶液中的c(OH-)>c(H+)
CH3COOH+OH-使得溶液中的c(OH-)>c(H+)
⑥在碳酸钙的沉淀溶解平衡体系中,加入稀盐酸,平衡向溶解的方向移动
⑦在氯化银的沉淀溶解平衡体系中,加入碘化钾固体,氯化银沉淀可转化为碘化银沉淀
| A.①②③④⑤ | B.②③④⑤⑥ | C.②③⑤⑥⑦ | D.①②⑤⑥⑦ |
25℃时,在BaSO4的饱和溶液中存在:BaSO4(s)? Ba2+(aq)+SO42-(aq),Ksp=1.1025×10-10,在该温度下有关BaSO4的溶度积和溶解平衡的叙述正确的是 ( )
| A.向c(SO42-)=1.05×10-5mol/L的BaSO4溶液中加入BaSO4固体,c(SO42-)增大 |
| B.向该饱和溶液中加入Ba(NO3)2固体,则BaSO4的溶度积常数增大 |
| C.向该饱和溶液中加入Na2SO4固体,则该溶液中c(Ba2+)>c(SO42-) |
| D.向该饱和溶液中加入BaCl2固体,则该溶液中c(SO42-)减小 |
已知25℃时,AgI饱和溶液中c(Ag+)为1.22×10-8mol·L-1,AgCl的饱和溶液中c(Ag+)为1.30×10-5mol·L-1。若在5 mL含有KCl和KI浓度均为0.01 mol·L-1的混合溶液中,滴加8 mL 0.01 mol·L-1的AgNO3溶液,则下列叙述中不正确的是
| A.反应后溶液中离子浓度大小关系为:c(NO3-)>c(Ag+)>c(Cl-)>c(I-) |
| B.溶液中先产生的是AgI沉淀 |
| C.AgCl的KsP的数值为1.69×10-10 |
| D.若在AgCl悬浊液中滴加KI溶液,白色沉淀会转变成黄色沉淀 |
下列说法正确的是
| A.pH=7的溶液一定是中性溶液 |
| B.能自发进行的化学反应,不一定是△H<0、△S>0 |
| C.白色污染、绿色食品中的“白”“绿”均指相关物质的颜色 |
| D.Ksp不仅与难溶电解质的性质和温度有关,而且与溶液中的离子浓度有关 |
中学化学教材中有大量数据,下列为某同学对数据的利用情况,其中不正确的是:
| A.用溶解度数据判断煮沸Mg(HCO3)2溶液得到的产物是Mg(OH)2而不是MgCO3 。 |
| B.用pH数据推测不同强酸弱碱盐在水溶液中水解程度的大小。 |
| C.用反应热数据的大小判断不同反应的反应速率的快慢。 |
| D.用平衡常数的大小判断化学反应可能进行的程度。 |
已知:25°C时,Ksp〔Mg(OH)2〕=5.61×10-12,Ksp〔MgF2〕=7.42×10-11。下列说法正确的是
| A.25°C时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大 |
| B.25°C时,在Mg(OH)2的悬浊液加入少量的NH4Cl固体,c(Mg2+)增大 |
| C.25°C时,Mg(OH)2固体在20mL0.01 mol·L-1氨水中的Ksp比在20mL0.01mol·L-1NH4Cl溶液中的Ksp小 |
| D.25°C时,在Mg(OH)2的悬浊液中加入NaF溶液后,Mg(OH)2不可能转化为MgF2 |
CrO3和K2Cr2O7均易溶于水,这是工业上造成铬污染的主要原因。净化处理方法之一是将含+6价Cr的废水放入电解槽内,用铁作阳极,加入适量的NaCl进行电解:阳极区生成的Fe2+和Cr2O72-发生反应,生成的Fe3+和Cr3+在阴极区与OH-结合生成Fe(OH)3和Cr(OH)3沉淀除去(已知Ksp Fe(OH)3=4.0×10-38,Ksp Cr(OH)3=6.0×10-31)。已知电解后的溶液中c(Fe3+)为4×10-14 mol·L-1,此时溶液的pH(室温下测得)和溶液中c(Cr3+)分别为
| A. 6; 6×10-7 mol·L-1 | B. 7; 1×10-5 mol·L-1 |
| C.7 ; 4×10-8 mol·L-1 | D. 6; 1× 10-5 mol·L-1 |
海水中含有丰富的镁资源。某同学设计了从模拟海水中制备的实验方案:

| 模拟海水中的离子 |
|
|
|
|
|
| 浓度( |
0.439 |
0.050 |
0.011 |
0.560 |
0.001 |
注:溶液中某种离子的浓度小于,可认为该离子不存在;
实验过程中,假设溶液体积不变
下列说法正确的是
| A. |
沉淀物
|
| B. |
溶液
|
| C. |
溶液
|
| D. |
步骤②中若改为加入4.2
|
试题篮
()