已知25℃时,Mg(OH)2的Ksp = 5.6×10-12,MgF2的Ksp = 7.4×10-11。下列说法正确的是
| A.25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大 |
| B.25℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者c(Mg2+)大 |
| C.25℃时,Mg(OH)2固体在同体积同浓度的氨水和NH4Cl溶液中的Ksp 比较,前者小 |
| D.25℃时,在Mg(OH)2的悬浊液中加入饱和NaF溶液后,Mg(OH)2不可能转化成MgF2 |
某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示。据图分析,下列判断错误的是
| A.Ksp<Ksp2 |
| B.加适量NH4Cl固体可使溶液由a点变到b点 |
| C.c、d两点代表的溶液中c(H+)与c(OH-)乘积相等 |
| D.Fe(OH)3、Cu(OH)2分别在b、c两点代表的溶液中达到饱和 |
一定温度下的难溶电解质AmBn在水溶液中达到溶解平衡时。已知下表数据
| 物质 |
Fe(OH)2 |
Cu(OH)2 |
Fe(OH)3 |
| Ksp/25℃ |
8.0×10-16 |
2.2×10-20 |
4.0×10-38 |
| 完全沉淀时的pH范围 |
≥9.6 |
≥6.4 |
3~4 |
对含等物质的量的CuSO4、FeSO4、Fe2(SO4)3的混合溶液的说法,不科学的是( )
A.向该溶液中加少量铁粉即能观察到红色固体析出
B.向该混合溶液中逐滴加入NaOH溶液,最先看到红褐色沉淀
C.该溶液中c(SO42-):{c(Cu2+)+c(Fe2+)+c(Fe3+)}>5:4
D.向该溶液中加入适量氯水,并调节pH值到3~4后过滤,得到纯净的CuSO4溶液
已知:25°C时,Ksp[Mg(OH)2]=5.61×10-12,Ksp[MgF2]=7.42×10-11。下列说法正确的是
| A.25°C时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大 |
| B.25°C时,在Mg(OH)2的悬浊液加入少量的NH4Cl固体,c(Mg2+)增大 |
| C.25°C时Mg(OH)2固体在20 mL 0.01 mol/L氨水中的Ksp比在20mL 0.01mol/L NH4Cl溶液中的Ksp小 |
| D.25°C时,在Mg(OH)2的悬浊液加入NaF溶液后,Mg(OH)2不可能转化成为MgF2 |
下列说法正确的是( )
A.用坩埚灼烧MgCl2·6H2O的反应式:MgCl2·6H2O MgCl2+6H2O MgCl2+6H2O |
B.KSCN和FeCl3混合液着存在平衡:3KSCN+FeCl3 Fe(SCN)3+3KCl,加入少量KCl固体后溶液颜色不发生变化。 Fe(SCN)3+3KCl,加入少量KCl固体后溶液颜色不发生变化。 |
| C.常温下,将pH=2的稀硫酸稀释10倍,其中各离子的物质的量浓度都变为原来的十分之一。 |
| D.某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示,溶度积常数(Ksp=c(Ba2+)·c(SO42-)。则加入Na2SO4可使溶液由a点变到b点;通过蒸发可以使溶液由d 点变到c 点。 |
下表是五种银盐的溶度积常数(25℃):
| 化学式 |
AgCl |
Ag2SO4 |
Ag2S |
AgBr |
AgI |
| 溶度积 |
1.8×10-10 |
1.4×10-5 |
6.3×10-50 |
7.7×10-13 |
8.51×10-16 |
下列说法错误的是( )
A.五种物质在常温下溶解度最大的是Ag2SO4
B.将氯化银溶解于水后,向其中加入Na2S,则可以生成黑色沉淀
C.对于AgCl、AgBr和AgI三种物质在常温下的溶解度随着氯、溴、碘的顺序增大
D.沉淀溶解平衡的建立是有条件的,外界条件改变时,平衡也会发生移动
工业上制备氯化铜时,是将浓盐酸用蒸气加热至80℃左右,慢慢加入粗制氧化铜粉末(含杂质氧化亚铁),充分搅拌,使之溶解,反应如下:CuO+2HCl===CuCl2+H2O FeO+2HCl===FeCl2+H2O; 已知:pH≥9.6时,Fe2+以Fe(OH)2形式完全沉淀;pH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀 ;pH在3~4时,Fe3+以Fe(OH)3的形式完全沉淀.除去溶液中的Fe2+,可以采用的方法是
;pH在3~4时,Fe3+以Fe(OH)3的形式完全沉淀.除去溶液中的Fe2+,可以采用的方法是
| A.直接加碱,调整溶液pH≥9.6 | B.加纯铜粉,将Fe2+还 原出来 原出来 |
| C.先将Fe2+氧化成Fe3+,再调整pH在3~4 | D.通入硫化氢,使Fe2+直接沉淀 |
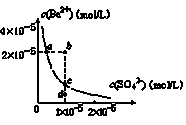
已知Ag2SO4的Ksp为2.0×10-5,将适量Ag2SO4固体溶于100 mL水中至刚好饱和, 该过程中Ag+和SO42-浓度随时间变化关系如右图(饱和Ag2SO4溶液中c(Ag+)="0.034" mol/L)。若t1时刻在上述体系中加入100 mL 0.020 mol/L Na2SO4溶液,下列示意图中,能正确表示t1时刻后Ag+和SO42-浓度随时间变化关系的是 
已知25 ℃时,AgCl 的溶度积Ksp=1.8×10-10,则下列说法正确的是( )
| A.向饱和AgCl水溶液中加入盐酸,Ksp值变大 |
| B.AgNO3溶液与NaCl溶液混合后的溶液中,;一定有c(Ag+)=c(Cl-) |
| C.温度一定时,当溶液中c(Ag+)×c(Cl-)=Ksp时,此溶液为AgCl的饱和溶液 |
| D.将固体AgCl加入到较浓的KI溶液中,部分AgCl转化为AgI,AgCl溶解度小于AgI |
某温度时,AgCl在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是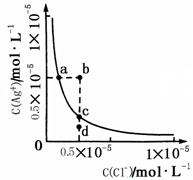
| A.加入NaCl可以使溶液由a点变到b点 |
| B.向AgCl饱和溶液中加入水, C(Ag+)增大 |
| C.d点无AgCl沉淀生成 |
| D.a点对应的Ksp大于c点对应的Ksp |
已知25℃时,AgC1、AgBr、Agl的Ksp分别为1.8×l0-l0、5.O×10—13、8.3×10—17,用AgNO3标准溶液滴定卤素离子的过程,以滴入AgNO3溶液的体积为横坐标,pX为纵坐标:[pX= -lgc(X )],就可绘得滴定曲线。现以0.1 mol·L-l AgNO3溶液分别滴定20.00 mL 0.1 mol·L-lCl
)],就可绘得滴定曲线。现以0.1 mol·L-l AgNO3溶液分别滴定20.00 mL 0.1 mol·L-lCl 、Br
、Br 、I
、I 绘得滴定曲线如图,下列有关说法中正确的是
绘得滴定曲线如图,下列有关说法中正确的是
A.a、b、c分别表示Cl 、Br 、Br 、I 、I |
B.a、b、c分别表示I 、Br 、Br 、Cl 、Cl |
C.a、b、c分别表示Br 、I 、I 、Cl 、Cl |
D.用硝酸银滴定法测定试样中c(Cl ),可用KI作指示剂 ),可用KI作指示剂 |
已知CuSO4溶液分别与Na2CO3溶液、Na2S溶液的反应情况如下:
(1) CuSO4 +Na2CO3
主要:Cu2+ + CO32─ + H2O = Cu(OH)2↓+ CO2↑
次要:Cu2+ + CO32─=" " CuCO3↓
(2) CuSO4 +Na2S
主要:Cu2+ + S2─ =" " CuS↓
次要:Cu2+ + S2─+ 2H2O = Cu(OH)2↓+ H2S↑
则下列几种物质的溶解度大小的比较中,正确的是
| A.CuS <Cu(OH)2<CuCO3 | B.CuS >Cu(OH)2>CuCO3 |
| C.Cu(OH)2>CuCO3>CuS | D.Cu(OH)2<CuCO3<CuS |
硫酸锶(SrSO4)在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是
| A.温度一定时,Ksp(SrSO4)随c(SO42—)的增大而减小 |
| B.三个不同温度中,313 K时Ksp(SrSO4)最大 |
| C.283 K时,图中a点对应的溶液是饱和溶液 |
| D.283 K下的SrSO4饱和溶液升温到363 K后变为不饱和溶液 |
化学中常用图像直观地描述化学反应的进程或结果。下列图像描述正确的是 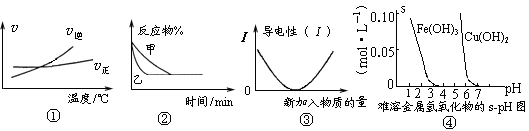
A.根据图①可判断可逆反应“A2(g)+3B2(g) 2AB3(g)”的ΔH>0 2AB3(g)”的ΔH>0 |
B.图②表示压强对可逆反应2A(g)+2B(g) 3C(g)+D(s)的影响,乙的压强大 3C(g)+D(s)的影响,乙的压强大 |
| C.图③可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化 |
| D.根据图④,若除去CuSO4溶液中的Fe3+可采用向溶液中加入适量CuO,至pH在4左右 |
试题篮
()