(1)已知t ℃时AgCl的Ksp=2×10-10;(2)在t ℃时,Ag2CrO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是。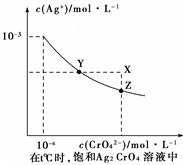
| A.在t ℃时,Ag2CrO4的Ksp为1×10-9 |
| B.t ℃时,在饱和Ag2CrO4溶液中加入K2CrO4 可使溶液由Y点到X点 |
| C.在t ℃时,以0.01 mol/L AgNO3溶液滴定20mL0.01 mol/L KCl和0.01 mol/L的K2CrO4的混和溶液,Cl-先沉淀 |
| D.在t ℃时,AgCl的溶解度大于Ag2CrO4 |
已知25 ℃时,电离常数Ka(HF)=3.6×10-4mol·L-1,溶度积常数Ksp(CaF2)=1.46×10-10,Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.O×10一16。下列说法正确的是
| A.25 ℃时,O.1 mol·L-1 HF溶液pH=l,Ksp(CaF2)随温度和浓度的变化而变化 |
| B.向1 L0.2 mol·L-1 HF溶液中加入1 L O.2 mol·L-1 CaCl2溶液,没有沉淀产生 |
| C.AgCl不溶于水,不能转化为AgI |
D.常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于 mol·L-1 mol·L-1 |
下列溶液或浊液中,关于离子浓度的说法正确的是
| A.一定浓度的氨水加水稀释的过程中,c(NH4+)/ c(NH3·H2O)的比值减小 |
| B.浓度均为0.1 mol·L-1的Na2CO3、NaHCO3混合溶液中:c(CO32-) > c(HCO3-),且2c(Na+)=3[c(CO32-)+c(HCO3-)] |
| C.0.2 mol·L-1的醋酸(CH3COOH)溶液与0.1 mol·L-1 NaOH溶液等体积混合后:c(CH3COO-) + 2c(OH-) = c(CH3COOH) + 2c(H+) |
| D.常温下,已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2Cr2O4)=2.0×10-12,则Ag2CrO4悬浊液中的c(Ag+)一定小于AgCl悬浊液中的c(Ag+) |
下列有关计算的分析正确的是
| A.某溶液100mL,其中含硫酸0.03mol,硝酸0.04mol,若在该溶液中投入1.92 g铜粉微热,反应后放出一氧化氮气体约为0.015mol |
| B.室温时,在容积为a mL的试管中充满NO2气体,然后倒置在水中到管内水面不再上升时为止;再通入b mL O2,则管内液面又继续上升,测得试管内最后剩余气体为c mL,且该气体不能支持燃烧.则a、b的关系是a=4b+c |
C.已知某温度Ksp(Ag2S)=6×10-50,Ksp(AgCl)=2×10-6,则2AgCl(s)+S2-(aq) Ag2S(s)+2Cl-(aq)的平衡常数约为6.7×10-37 Ag2S(s)+2Cl-(aq)的平衡常数约为6.7×10-37 |
D.在25 ℃下,将2a mol·L-1的氨水与0.02 mol·L-1的盐酸等体积混合,反应完全时溶液中c(NH4+)=c(Cl-),则用含a的代数式表示NH3·H2O的电离常数  |
下列叙述错误的是
| A.在加热搅拌条件下加入MgO,可除去MgCl2溶液中的Fe3+ |
| B.pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍 |
| C.常温下,CH3COONa和CH3COOH的混合溶液中(pH=7):c(Na+)=c(CH3COO-)>c(CH3COOH)>c(H+)=c(OH-) |
| D.常温下,Cd(OH)2和Co(OH)2的混合悬浊液中,c(Cd2+)是c(Co2+)的3.5倍。已知:KSP(Cd(OH)2)=7.2×10-15, KSP(Co(OH)2)=1.8×10-15 |
实验:①0.1 mol/L AgNO3溶液和0.1 mol/L NaCl溶液等体积混合得到浊液,过滤。
②分别取少量①的滤液,分别滴加等浓度等体积的饱和Na2S溶液、饱和Na2SO4溶液,前者出现浑浊,后者溶液仍澄清。
③取少量①的沉淀,滴加几滴氨水,沉淀逐渐溶解。
下列分析不正确的是
| A.实验②证明了①的滤液中含有Ag+,由此推断①的滤液中也含有Cl¯ |
| B.实验②证明了该温度下Ag2S比Ag2SO4更难溶解 |
| C.实验③的溶液中含有Ag(NH3)2+微粒 |
| D.由实验③推测:若在①的沉淀中滴加NaOH溶液,沉淀也能溶解 |
已知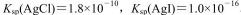 .下列说法中正确的是
.下列说法中正确的是
| A.常温下,AgCl饱和溶液中的c(Ag+)比AgI饱和溶液中c(Ag+)小 |
B.常温下,AgCl若要在NaI溶液中开始转化为Agl,则c(NaI)必须不低于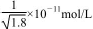 |
C.只能由 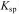 较大的不溶物转化为 较大的不溶物转化为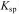 较小的不溶物 较小的不溶物 |
D.利用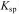 的大小可直接比较难溶物的溶解度 的大小可直接比较难溶物的溶解度 |
常温下,几种难溶电解质的溶度积和弱酸的电离常数如下表所示:
则下列说法不正确的是
| A.相同温度、相同浓度的钠盐溶液的pH:Na2S>Na2CO3>NaHS>NaCl>NaHSO4 |
| B.在NaHS溶液中滴加硫酸铜溶液,生成黑色沉淀:HS-+Cu2+===CuS↓+H+ |
| C.除去锅炉中的水垢时,通常先加入足量硫酸钠溶液,将碳酸钙转化成硫酸钙,然后再用酸液处理 |
| D.在Mg(HCO3)2溶液中滴加足量澄清石灰水发生反应的离子方程式为Mg2++2HCO+2Ca2++4OH-===Mg(OH)2↓+2CaCO3↓+2H2O |
下列排列顺序正确的是
A.常温下将0.1 mol·L-1NH4Cl溶液与0.05 mol·L-1NaOH溶液等体积混合,c(Cl-) > c(Na+) > c(NH4+) > c (OH-) > c (H+)
B.常温下,物质的量浓度相等的①NH4HSO4②CH3COONH4③NH4Cl三种溶液中c(NH4+):①>③>②
C.0.1mol·L-1的NaHA溶液,其pH=11,则溶液中:c(HA-)>c(OH-)>c(A2-)>c(H2A)
D.在相同条件下,将足量AgCl加入等体积的①0.01 mol•L-1AgNO3溶液②0.1 mol•L-1KCl溶液③蒸馏水三种液体中,所能溶解的AgCl质量关系为:①>②>③
下列说法正确的是
| A.在温度不变的条件下向CaSO4饱和溶液中加入Na2SO4溶液,CaSO4将会析出,但Ksp不会发生改变 |
| B.甲基环己烷一溴代物有4种异构 |
| C.在pH<7的CH3COOH和CH3COONa的混合液中,一定有c(CH3COO-) > c(Na+) >c(H+)>c(OH-) |
| D.PH值等于3的两种酸按一定比例混合后PH值可能变为7 |
已知常温下:Ksp(AgCl)=1.8×10-10 mol2·L-2,Ksp(Ag2CrO4)=1.9×10-12 mol3·L-3,
下列叙述正确的是
| A.AgCl在饱和NaCl溶液中的Ksp比在纯水中的Ksp小 |
| B.向AgCl的悬浊液中加入NaBr溶液,白色沉淀转化为淡黄色,说明Ksp(AgCl)<Ksp(AgBr) |
| C.将0.001 mol·L-1的AgNO3溶液滴入0.001 mol·L-1的KCl 和0.001 mol·L-1的K2CrO4溶液中先产生Ag2CrO4沉淀 |
| D.向AgCl的悬浊液中滴加浓氨水,沉淀溶解,说明AgCl的溶解平衡向右移动 |
下列实验操作与预期实验目的或所得实验结论一致的是
| 选项 |
实验操作 |
实验目的或结论 |
| A |
某钾盐溶于盐酸,产生能使澄清石灰水变浑浊的无色无味气体 |
说明该钾盐是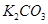 |
| B |
向含有少量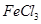 的 的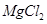 溶液中加入足量 溶液中加入足量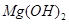 粉末,搅拌一段时间后过滤 粉末,搅拌一段时间后过滤 |
除去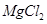 溶液中少量 溶液中少量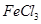 |
| C |
常温下,向饱和 溶液中加少量 溶液中加少量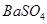 粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生 粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生 |
说明常温下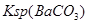 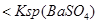 |
| D |
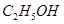 与浓硫酸170℃共热,制得的气体通入酸性 与浓硫酸170℃共热,制得的气体通入酸性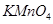 溶液 溶液 |
检验制得气体是否为乙烯 |
下列实验操作与预期实验目的或所得实验结论一致的是
| 选项 |
实验操作及现象 |
实验目的或结论 |
| A |
向1,2两试管中分别加入等浓度H2O2溶液10 mL、1 mL,再向H2O2溶液中分别滴入等浓度等体积CuSO4、FeCl3溶液;试管2中产生气体较快 |
证明FeCl3溶液的催化效率更高 |
| B |
硅酸钠溶液中滴入酚酞,溶液变红,再滴加稀盐酸,溶液红色变浅直至消失 |
证明非金属性:Cl>Si |
| C |
测定物质的量浓度相同的盐酸和醋酸溶液的pH;盐酸pH小于醋酸pH |
证明盐酸酸性比醋酸强 |
| D |
取5 mL,0.1mol/L的AgNO3溶液于试管中,向试管中加入1-2滴0.1mol/L的NaCl溶液,出现白色沉淀,再向该试管中加入2滴0.1mol/L的KI溶液,出现黄色沉淀(AgI沉淀为黄色)。 |
证明: Ksp(AgI) >Ksp(AgCl) |
下列有关电解质溶液中粒子浓度关系正确的是
| A.pH=1的NaHSO4溶液:c(H+)=c(SO42﹣)+c(OH﹣) |
| B.含有AgCl和AgI固体的悬浊液:c(Ag+)>c(Cl﹣)=c(I﹣) |
| C.CO2的水溶液:c(H+)>c(HCO3﹣)=2c(CO32﹣) |
| D.含等物质的量NaHC2O4和Na2C2O4的溶液:3c(Na+)=2[c(HC2O4﹣)+c(C2O42﹣)+c(H2C2O4)] |
25℃时,用Na2S沉淀Cu2+、Mn2+、Fe2+、Zn2+四种金属离子(M2+),所需S2-最低浓度的对数值lgc(S2-)与lgc(M2+)关系如图所示。下列说法正确的是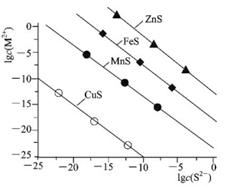
| A.Ksp(CuS)约为l×10-20 |
| B.向Cu2+浓度为10-5mol•L-1废水中加入ZnS粉末,会有CuS沉淀析出 |
| C.向l00mL浓度均为10-5mol•L-1 Zn2+、Fe2+、Mn2+的混合溶液中逐滴加入10-4mol•L-1 Na2S溶液,Zn2+先沉淀 |
| D.Na2S溶液中:2c(S2-)+2c(HS-)+2c(H2S)=c(Na+) |
试题篮
()