某温度下HF的电离常数Ka=3.3×10-4 mol·L-1,CaF2的溶度积常数Ksp=1.46×10-10(mol·L-1)3。在该温度下取浓度为0.31 mol·L-1的HF与浓度为0.002 mol·L-1的CaCl2溶液等体积混合。下列说法正确的是( )
| A.该温度下,0.31 mol·L-1的HF溶液的pH=2 |
| B.升高温度或增大浓度,HF的电离平衡常数都将增大 |
| C.两溶液混合不会产生沉淀 |
| D.向饱和的CaF2溶液中加水后,c(Ca2+)一定比加水前减小 |
下列图示与对应的叙述相符的是



甲 乙 丙 丁
A.图甲可以判断出反应A(g) + B(g) 2C(g) 的△H<0,T2>T1 2C(g) 的△H<0,T2>T1 |
B.图乙表示压强对可逆反应2A(g) + 2B(g) 3C(g) + D(s)的影响,乙的压强比甲的压强大 3C(g) + D(s)的影响,乙的压强比甲的压强大 |
| C.据图丙,若除去CuSO4溶液中的Fe3+可向溶液中加入适量CuO至pH≈4 |
| D.图丁表示25℃时,用0.1 mol·L—1盐酸滴定20 mL 0.1 mol·L-1 NaOH溶液,溶液的pH随加入盐酸体积的变化 |
已知Ksp(BaSO4 )= 1.1×10-10,Ksp(BaCO3)=2.5×10-9。下列说法中不正确的是
| A.BaSO4比BaCO3溶解度小,所以,BaCO3可以转化为BaSO4 |
| B.BaCO3、BaSO4均不溶于水,所以都可以做钡餐试剂 |
| C.向Na2CO3溶液中加入BaCl2和Na2SO4,当两种沉淀共存时,c(SO42—)/ c(CO32—) =4.4×10-2 |
| D.常温下,BaCO3若要在Na2SO4溶液中开始转化为BaSO4,则Na2SO4的浓度必须不低于2.2×10-6 mol·L-1 |
下表是25°C时某些盐的浓度积常数和弱酸的电离平衡常数,下列说法正确的是( )
| 化学式 |
AgCl |
Ag2CrO4 |
CH3COOH |
HClO |
H2CO3 |
| KSP或Ka |
KSP=1.8×10-10 |
KSP=2.0×10-12 |
Ka=1.8×10-5 |
Ka=3.0×10-8 |
Ka1=4.1×10-7 Ka2=5.6×10-11 |
A.相同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系是
c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+)
B.碳酸钠溶液中滴加少量氯水的离子方程式为CO32-+Cl2=HCO3-+Cl-+HClO
C.向0.1mol·L-1CH3COOH溶液中滴加NaOH溶液至c(CH3COOH):c(CH3COO-)=5:9,此时溶液pH=5
D.向浓度均为1×10-3mol·L-1的KCl和K2CrO4混合液中滴加1×10-3mol·L-1的AgNO3溶液,CrO42-先形成沉淀
一定温度下,三种碳酸盐的沉淀溶解平衡曲线如下图所示。已知:
。下列说法正确的是()

| A. |
|
| B. |
a 点可表示
|
| C. |
b 点可表示
|
| D. |
c 点可表示
|
已知298K时,Ksp(CaCO3)= 2.80×10-9,Ksp(CaSO4)= 4.90×10-5。若用难溶盐在溶液中的物质的量浓度来表示其溶解度,则下面的叙述正确的是( )
| A.298K时,CaSO4的溶解度约为7.00×10-2 mol/L |
| B.反应CaSO4(s) + CO32-= CaCO3(s) + SO42-在298K时的平衡常数K= Ksp(CaSO4) / Ksp(CaCO3) = 1.75×104 |
| C.CaCO3、CaSO4的饱和溶液的导电能力很弱,所以它们都是弱电解质 |
| D.升高温度,两种盐的溶度积与溶解度都保持不变 |
硫酸锶(SrSO4)在水中的沉淀溶解平衡曲线如下图所示。下列说法正确的是( )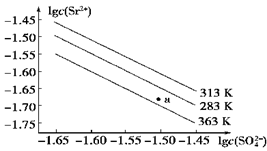
A.温度一定时,Ksp(SrSO4)随c(SO )的增大而减小 )的增大而减小 |
| B.三个不同温度中,313 K时Ksp(SrSO4)最大 |
| C.283 K时,图中a点对应的溶液是饱和溶液 |
| D.283 K下的SrSO4饱和溶液升温到363 K后变为不饱和溶液 |
工业上常用还原沉淀法处理含铬废水(Cr2O72—和CrO42—),其流程为:
已知:(1)步骤①中存在平衡:2Cr O42—(黄色)+2H+ Cr2O72—(橙色)+H2O
Cr2O72—(橙色)+H2O
(2)步骤③生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:
Cr(OH)3(s) Cr3+(aq)+3OH 一(aq)
Cr3+(aq)+3OH 一(aq)
(3)常温下,Cr(OH)3的溶度积Ksp=10-32;且当溶液中离子浓度小于10-5 mol·L-1时可视作该离子不存在下列有关说法中,正确的是( )
| A.步骤①中加酸,将溶液的pH 调节至2,溶液显黄色,CrO42—离子浓度增大 |
B.步骤①中当2v(CrO42 一)=v(Cr2O72—)时,说明反应2CrO42—(黄色)+2H+ Cr2O72—(橙色)+H2O 达到平衡状态 Cr2O72—(橙色)+H2O 达到平衡状态 |
| C.步骤②中,若要还原1 mol Cr2O72一离子,需要12 mol(NH4)2Fe(SO4)2·6H2O。 |
| D.步骤③中,当将溶液的pH 调节至6 时,则可认为废水中的铬已除尽 |
常温下,CaSO4在水中的沉淀溶解平衡曲线如图所示,已知 Ksp(CaSO4)=9×10-6。下列说法正确的是( )
| A.a点对应的KSP小于c点对应的KSP |
| B.a点变为b点将有沉淀生成 |
| C.加入蒸馏水可以使c点变为d点 |
D.含有大量 的溶液中肯定不存在Ca2+ 的溶液中肯定不存在Ca2+ |
下列说法正确的是
| A.常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4 |
| B.为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH,若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸 |
| C.用0.2000 mol/L NaOH标准溶液滴定HCl和CH3COOH的混合溶液(混合液中两种酸的浓度均为0.1 mol/L),至中性时,溶液中的酸未被完全中和 |
| D.相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1mol/L盐酸、③0.1 mol/L氯化镁溶液、④0.1mol/L硝酸银溶液中,所得溶液Ag+浓度大小关系:①>④>②>③ |
某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示。据图分析,下列判断错误的是
| A.Kap[Fe(OH)3]<Kap[Cu(OH)2] |
| B.加适量NH4Cl固体可使溶液由a点变到b点 |
| C.c、d两点代表的溶液中c(H+)与c(OH-)乘积相等 |
| D.Fe(OH)3、Cu(OH)2分别在b、c两点代表的溶液中达到饱和 |
在粗制CuSO4·5H2O晶体中常含有杂质Fe2+,为了除去Fe2+,先将混合物溶于水,加入一定量的H2O2,将Fe2+氧化成Fe3+,再调节溶液的pH=4,过滤、蒸发、结晶即可。下列说法正确的是
| A.由题目可知,Cu2+可以大量存在于pH=4的溶液中 |
| B.可用浓硫酸代替H2O2 |
| C.未加H2O2前的硫酸铜溶液pH < 4 |
| D.调节溶液pH=4可选择的试剂是氢氧化铜或氨水 |
常温下Ksp(AgCl)=1.56×10-10, Ksp(AgI)=1.0×10-16,将等体积的AgCl和AgI的饱和溶液的清夜混合,再向其中加入一定量的AgNO3固体,下列说法正确的是
| A.两清夜混合,AgCl和AgI都沉淀。 |
| B.向AgCl清夜加入AgNO3固体,c(Ag+)增大,Ksp(AgCl)也增大 |
| C.若AgNO3固体足量,AgCl和AgI都可沉淀,但以AgCl沉淀为主 |
| D.若取0.235克AgI固体放入100ml(忽略体积变化),c(I-)=0.01mol/l |
某温度时,Ag2SO4在水中的沉淀溶解平衡曲线如图所示。该温度下,下列说法正确的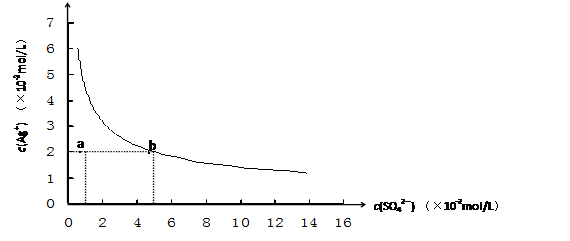
| A.含有大量SO42-的溶液中肯定存在Ag+ |
| B.0.02mol/L的AgNO3溶液与0.2mol/L的Na2SO4溶液等体积混合不会生成沉淀 |
| C.Ag2SO4的溶度积常数(Ksp)为1×10-3 |
| D.a点表示Ag2SO4的不饱和溶液,蒸发可以使溶液由a点变到b点 |
试题篮
()