(18分)银是一种在工业、生活上有广泛用途的金属。
已知:①金属在水中存在如下溶解平衡过程:M  Mx+ + xe-,
Mx+ + xe-,
氢气在水溶液中也存在如下平衡过程:H2 2H+ + 2e-
2H+ + 2e-
②Ag2S 的Ksp=6.7×10-50; AgCl的Ksp=1.6×10-10
据此回答下列有关问题:
(1)银质餐具可杀菌消毒,原因是_________________(用适当的方程式和文字表述说明);金属银与氢硫酸可反应生成黑色固体和无色气体,写出该反应的化学方程式_______________
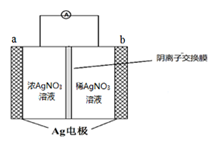
(2)金属银与硝酸银溶液组成电池示意图如右,a电极的反应为________________,NO3-从电池________侧溶液向电池_______侧溶液移动 (填“左”或“右”)。
(3)硝酸银见光或受热易分解为Ag、NO2、O2,反应中生成NO2、O2的 物质的量之比为___________,将混合气体通过水吸收后,剩余气体为________________
(4)已知:Ag+(aq) + 2NH3•H2O(aq)  [Ag(NH3)2]+ (aq) + 2H2O K=1.6×107,写出AgCl溶于氨水的离子方程式________________________;计算该反应的平衡常数K=___________。在氯化银溶于氨水后的溶液中滴加稀硝酸,会再产生白色氯化银沉淀,滴加硝酸至刚好沉淀完全,取上层清液测其pH,发现呈酸性,主要原因是_______________(用离子方程式表示)。
[Ag(NH3)2]+ (aq) + 2H2O K=1.6×107,写出AgCl溶于氨水的离子方程式________________________;计算该反应的平衡常数K=___________。在氯化银溶于氨水后的溶液中滴加稀硝酸,会再产生白色氯化银沉淀,滴加硝酸至刚好沉淀完全,取上层清液测其pH,发现呈酸性,主要原因是_______________(用离子方程式表示)。
白云石的主要成份是CaCO3·MgCO3,在我国有大量的分布。以白云石为原料生产的钙镁系列产品有广泛的用途。白云石经煅烧、熔化后得到钙镁的氢氧化物,再经过碳化实现Ca2+、Mg2+的分离。
已知:碳化反应是放热反应,化学方程式Ca(OH)2+Mg(OH)2+3CO2 CaCO3+Mg(HCO3)2+H2O。完成下列填空:
CaCO3+Mg(HCO3)2+H2O。完成下列填空:
(1)Ca(OH)2的碱性比Mg(OH)2的碱性 (填“强”或“弱”)
Ca(OH)2的溶解度比Mg(OH)2的溶解度 (填“大”或“小”)。
(2)碳化温度保持在50~60℃。温度偏高不利于碳化反应,原因是 、 (至少写2点)。温度偏低也不利于碳化反应,原因是 。
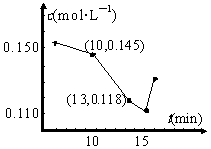
(3)已知某次碳化时溶液中钙离子浓度随时间的变化如图所示,在10min到13min之内钙离子的反应速率为 。用化学方程式表示15min之后钙离子浓度增大的原因 。
已知草酸镍晶体(NiC2O4·2H2O)难溶于水,工业上从废镍催化剂(成分主要为Ni,含有一定量的Al2O3、Fe、SiO2、CaO等)制备草酸镍晶体的流程如图所示:

已知:①相关金属离子生成氢氧化物沉淀的pH如下表:

②KSP(CaF2) =1.46×10-10 ③当某物质浓度小于1.0×10-5 mol/L时,视为完全沉淀
(1)请写出一种能提高酸浸速率的措施________________。
(2)试剂a是一种绿色氧化剂,写出“氧化”时反应的离子方程式 。
(3)pH的调控范围为 ,试用化学反应原理的相关知识解释滤渣Ⅱ的生成
(4)写出“沉镍”时反应的离子方程式 ,证明Ni2+已经沉淀完全的实验步骤及现象是 ,当Ca2+沉淀完全时,溶液中c(F-)>_____________(写出计算式即可)。
(5)操作a的内容是 。
(本小题满分14分)
I.H2A在水中存在以下平衡:H2A  H++HA-,HA
H++HA-,HA H++A2- 。
H++A2- 。
(1)NaHA溶液显酸性,则溶液中离子浓度的大小顺序为_____________。
(2)常温时,若向0.1 mol/L的NaHA溶液中逐滴滴加0.1mol/L KOH溶液至溶液呈中性。此时该混合溶液的下列关系中,一定正确的是_____________。
A.c(Na+ )>c(K+ ) B.c(H +)•c(OH )=1×10-14
C.c(Na+ )=c(K+ ) D.c(Na+ )+c(K+ )=c(HA )+c(A2- )
(3)已知常温下H2A的钙盐(CaA)饱和溶液中存在以下平衡:
CaA(s)  Ca2+ (aq)+A2- (aq)
Ca2+ (aq)+A2- (aq)
滴加少量Na2A固体, c(Ca2+ )_____________(填“增大”、“减小”或“不变”),原因是______________。
Ⅱ.含有Cr2O72- 的废水毒性较大,某工厂废水中含4.00×10-3 mol/L 的Cr2O7。为使废水能达标排放,作如下处理:
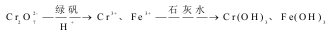
(1)该废水中加入FeSO4·7H2O和稀硫酸,发生反应的离子方程式为:_____________。
(2)欲使25 L该废水中Cr2O7转化为Cr3+,理论上需要加入_____________g FeSO4·7H2O。
(3)若处理后的废水中残留的 c(Fe )=1×10-13mol/L ,则残留的 Cr3+的浓度为____________。(已知:Ksp[Fe(OH)3]≈1.0×10-38mol,/L ,Ksp[Cr(OH)3]≈1.0×10-31 mol/L )
(1)室温下pH=9的NaOH溶液和pH=9的CH3COONa溶液,设由水电离产生的OH-的物质的量浓度分别为A和B,则A和B的关系为 。
(2)在纯碱溶液中滴入酚酞,溶液变红色,若在该溶液中再滴入过量的BaCl2溶液,所观察到的现象是 ,其原因是 。
(3)对于盐AmBn的溶液:
①若为强酸弱碱盐,其水解的离子方程式是 ;
②若为弱酸强碱盐,其水解的离子方程式是 。
(4)已知KSP (Ag2CrO4)=1.12×10-12,将等体积的4×10-3mo1·L-1的AgNO3和4×10-3mo1·L–1K2CrO4混合,________产生Ag2CrO4沉淀(填“能”或“不能”)。
(13分)工业上常回收冶炼锌废渣中的锌(含有ZnO、FeO、Fe2O3、CuO、Al2O3等杂质,并用来生产ZnSO4·6H2O晶体,其工艺流程如下,有关氢氧化物沉淀时的pH如下表。

| 氢氧化物 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Zn(OH)2 |
| 开始沉淀的pH |
3.3 |
1.5 |
6.5 |
5.4 |
| 沉淀完全的pH |
5.2 |
3.7 |
9.7 |
8.0 |
(1)上述工艺流程中多处涉及“过滤”,实验室中过滤操作需要使用的玻璃仪器有________。
(2)在“除杂Ⅰ”步骤中,需再加入适量H2O2溶液的目的是_____。为使Fe(OH)3、Al(OH)3沉淀完全,而Zn(OH)2不沉淀,应控制溶液的pH范围为______。为控制上述pH范围可选择加入的试剂或药品是________。
A.ZnO B.氨水 C.固体NaOH D.ZnCO3
(3)在“除杂Ⅱ”步骤中,加入Zn粉的作用是_______。“操作A”的名称是_______。
(4)常温下,已知Ksp〔Cu(OH)2〕=2×10-20,某CuSO4溶液里c(Cu2+)=0.02mol/L,如果要生成Cu(OH)2沉淀,则应调整溶液pH大于___________。
碱式氧化镍(NiOOH)可用作镍氢电池的正极材料。以含镍(Ni2+)废液为原料生产NiOOH的一种工艺流程如下:

(1)加入Na2CO3溶液时,确认Ni2+已经完全沉淀的实验方法是 。
(2)已知Ksp[Ni(OH)2]=2×10-15,欲使NiSO4溶液中残留c(Ni2+)≤2×10-5 mol·L-1,调节pH的范围是 。
(3)写出在空气中加热Ni(OH)2制取NiOOH的化学方程式: 。
(4)若加热不充分,制得的NiOOH中会混有Ni(OH)2,其组成可表示为xNiOOH·yNi(OH)2。现称取9.18 g样品溶于稀硫酸,加入100 mL 1.0 mol·L-1 Fe2+标准溶液,搅拌至溶液清亮,定容至200 mL。取出20.00 mL,用0.010 mol·L-1 KMnO4标准溶液滴定,用去KMnO4标准溶液20.00 mL,试通过计算确定x、y的值(写出计算过程)。涉及反应如下(均未配平):
NiOOH+Fe2++H+—Ni2++Fe3++H2O Fe2++MnO4-+H+—Fe3++Mn2++H2O
【化学—选修2化学与技术】某电镀铜厂有两种废水需要处理,一种废水中含有CN-离子,另一种废水中含有Cr2O72-离子。该厂拟定如图所示的废水处理流程。
回答以下问题:
(1)上述处理废水的流程中主要使用的方法是__________________
(2)②中使用的NaClO溶液呈碱性,用离子方程式解释原因________________。
(3)②中反应后无气体放出,该反应的离子方程式为___________________。
(4)③中反应时,每0.4 mol Cr2O72-转移2.4 mol的电子,该反应的离子方程式为______________。
(5)取少量待检水样于试管中,先加入NaOH溶液,观察到有蓝色沉淀生成,继续加入NaOH溶液,直到不再产生蓝色沉淀为止,再加入Na2S溶液,有黑色沉淀生成,且蓝色沉淀逐渐减少,请你使用化学用语,结合必要的文字解释其原因______________________。
工业制备氯化铜时,将浓盐酸加热至80 ℃左右,慢慢加入粗CuO粉末(含杂质Fe2O3、FeO),充分搅拌,使之溶解,得一强酸性的混合溶液,现欲从该混合溶液中制备纯净的CuCl2溶液,采用以下步骤[参考数据:pH≥9.6时,Fe2+完全水解成Fe(OH)2;pH≥6.4时,Cu2+完全水解成Cu(OH)2;pH≥3.7时,Fe3+完全水解成Fe(OH)3]。请回答以下问题:
(1)第一步,如果直接调整pH=9.6,不能将Cu2+和Fe2+分离除去,理由是:___________。现有下列几种常用的氧化剂,可用于氧化除去混合溶液中Fe2+,其中最好选:________。
①KMnO4 ②H2O2 ③NaClO ④浓HNO3
(2)除去溶液中Fe3+的方法是调整溶液的pH=3.7,现有下列试剂均可以使强酸性溶液的pH调整到3.7,可选用的有________。
①Cu(OH)2 ②氨水 ③Cu2(OH)2CO3 ④NaOH
(3)直接加热溶液,蒸干______(选填“能”或“不能”)得到氯化铜晶体(CuCl2·2H2O)。
(6分)某同学在学习沉淀溶解平衡时发现以下表中信息:
| |
AgCl |
AgBr |
Ag2CrO4 |
| 颜色 |
白色 |
浅黄色 |
砖红色 |
| 溶解度(mol·L-1) |
1.3×10-4 |
1.7×10-7 |
6.5×10-5 |
| 溶度积常数(KSP) |
1.7×10-12mol2·L-2 |
5.0×10-13mol2·L-2 |
? |
(1)请利用表中信息计算Ag2CrO4的溶度积常数KSP = ;
(2)沉淀滴定所用的指示剂本身就是一种沉淀剂,用AgNO3滴定KCl溶液中Cl-的含量时甲同学想用K2CrO4作指示剂;
①现有浓度均为0.001mol·L-1的KCl和K2CrO4的混合液,该同学取混合液20mL,用已知浓度的AgNO3溶液滴定,试计算当Cl-沉淀完全时,CrO42-是否开始沉淀(当溶液中某离子浓度小于1×10-5mol·L-1时认为沉淀完全)。
②根据表中信息和上述计算,请判断K2CrO4能否用作AgNO3滴定KCl实验的指示剂 (填“能”或“不能”);若能则滴定终点的颜色变化是 (若不能该空不填)。
(一)氮氧化物是空气的主要污染物,消除氮氧化物污染有多种方法。用催化技术可将超音速飞机尾气中的NO和CO转变成CO2和N2,其反应为:2NO+2CO 2CO2+N2,为了测定在某种催化剂作用下的反应速率,在某温度下测得不同时间的NO和CO浓度如下表:
2CO2+N2,为了测定在某种催化剂作用下的反应速率,在某温度下测得不同时间的NO和CO浓度如下表:
| 时间(s) |
0 |
2 |
4 |
| c(NO) ( mol·L-1) |
1.00×10-3 |
2.50×10-4 |
1.00×10-4 |
| c(CO) ( mol·L-1) |
3.60×10-3 |
c’ |
2.70×10-3 |
回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)前4s内的平均反应速率v(NO)= 。c’= 。
(2)当质量一定时,增大固体催化剂的表面积可提高化学反应速率。下图表示在其他条件不变时,上述反应中二氧化碳浓度随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。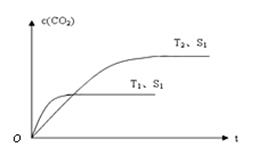
①该反应的ΔH 0(填“>”、“<”或“=”)。
②若催化剂的表面积S1>S2,在答题卡图中画出c(CO2) 在T2、 S2条件下达到平衡过程中的变化曲线。
(3)在恒容的密闭容器中,上述反应达到平衡后,改变某一条件,下列示意图正确的是
(二)沉淀溶解平衡也有平衡常数,称为溶度积常数,符号为Ksp,对于某沉淀溶解平衡:
MmAn(s)  mMn+(aq) + nAm-(aq),Ksp=[c(Mn+)]m·[c(Am-)]n。M(Ca(OH)2)=74g/mol
mMn+(aq) + nAm-(aq),Ksp=[c(Mn+)]m·[c(Am-)]n。M(Ca(OH)2)=74g/mol
(1)常温时,Fe(OH)3的Ksp=1×10-38,要使溶液中的Fe3+沉淀完全(残留在溶液中的c(Fe3+)<10-5 mol·L-1),则溶液的pH最小为 。
(2)某温度时,在100g水中溶解0.74g Ca(OH)2达到饱和,此时溶液的体积约为100 mL,则该温度下Ca(OH)2的溶度积常数Ksp____________。(写出计算过程)
工业上制备氯化铜时,是将浓盐酸用水蒸汽加热至80℃左右,慢慢加入粗制氧化铜粉(含杂质氧化亚铁),充分搅拌,使之溶解,反应如下:
CuO + 2HCl=CuCl2 + H2O ,FeO + 2HCl = FeCl2 + H2O。
已知:pH≥9.6时,Fe2+以Fe(OH)2的形式完全沉淀;
pH≥4.4时,Cu2+以Cu(OH)2的形式开始沉淀; pH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀;pH在3~4时,Fe3+以Fe(OH)3的形式完全沉淀。
(1)为除去溶液中Fe2+,可采用的方法是 。
(2)工业上为除去溶液中的_________。溶液的pH变化是 。
(3)若此溶液只含Fe3+时,要调整pH在3~4之间,此时最好向溶液中加入 。
(4)已知溶液中c(Cu2+)与溶液pH的关系为lg c(Cu2+)=8.6-2pH,若溶液中c(Cu2+)为1 mol/L,要保证此溶液中Cu2+刚好不发生Cu(OH)2沉淀,则溶液pH应为___________,此时溶液中的铁离子能否沉淀完全_________(填“能”或“否”)。
工业上制备BaCl2的工艺流程图如下: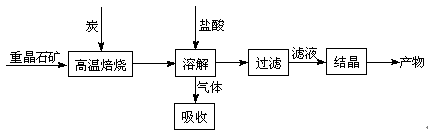
某研究小组在实验室用重晶石(主要成分BaSO4)对工业过程进行模拟实验。查表得
BaSO4(s) + 4C(s) 4CO(g) + BaS(s) △H1 =" 571.2" kJ·mol-1 ①
4CO(g) + BaS(s) △H1 =" 571.2" kJ·mol-1 ①
BaSO4(s) + 2C(s) 2CO2(g) + BaS(s) △H2=" 226.2" kJ·mol-1 ②
2CO2(g) + BaS(s) △H2=" 226.2" kJ·mol-1 ②
(1)气体用过量NaOH溶液吸收,得到硫化钠。Na2S水解的离子方程式为 。
(2)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,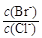 = 。
= 。
[Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10]
(3)反应C(s) + CO2(g) 2CO(g)的△H2= kJ·mol-1。
2CO(g)的△H2= kJ·mol-1。
(8分)物质在水溶液中可能存在电离平衡、盐的水解平衡或沉淀溶解平衡,它们都可看作化学平衡的一种。请根据所学化学知识回答下列问题:
(1)A为0.1 mol·L-1的(NH4)2SO4溶液,在该溶液中离子浓度由大到小的顺序为_______。
(2)B为0.1 mol·L-1的NaHCO3溶液,NaHCO3在该溶液中存在的平衡有(用离子方程式表示)______________。
(3)D为含有足量AgCl固体的饱和溶液,AgCl在溶液中存在如下平衡:AgCl(s)  Ag+(aq)+Cl-(aq) 在25℃时,AgCl的Ksp=1.8×10-10。现将足量AgCl分别放入下列液体中:①100 mL蒸馏水 ②100 mL 0.3 mol·L-1AgNO3溶液 ③100 mL 0.1 mol·L-1MgCl2溶液充分搅拌后冷却到相同温度,Ag+浓度由大到小的顺序为__________________(填序号),此时溶液②中Cl-物质的量浓度为__________________。
Ag+(aq)+Cl-(aq) 在25℃时,AgCl的Ksp=1.8×10-10。现将足量AgCl分别放入下列液体中:①100 mL蒸馏水 ②100 mL 0.3 mol·L-1AgNO3溶液 ③100 mL 0.1 mol·L-1MgCl2溶液充分搅拌后冷却到相同温度,Ag+浓度由大到小的顺序为__________________(填序号),此时溶液②中Cl-物质的量浓度为__________________。
市售一次电池品种很多,碱性锌锰电池在日常生活中用量很大。回收废旧锌锰电池并进行重新处理,可以获得MnO2及其他副产品,其工艺流程如下:
已知:“锰粉”的主要成分有MnO2、Zn(OH)2、MnOOH、碳粉,还含有少量铁盐和亚铁盐。常温下,生成氢氧化物沉淀的pH如下表:
| 物质 |
Fe(OH)3 |
Fe(OH)2 |
Zn(OH)2 |
Mn(OH)2 / Mn(OH)3 |
| 开始沉淀pH |
2.7 |
7.6 |
5.7 |
8.3 |
| 完全沉淀pH (c≤1.0×10-5mol/L) |
3.7 |
9.6 |
8.0 |
8.8 |
(1)加入NaOH溶液调节pH=8.0,目的是______________________________;计算常温下Zn(OH)2的溶度积常数Ksp[Zn(OH)2]=____________________。
(2)写出滤液2中的Mn2+变成MnO2的离子方程式_______________________________。
(3)写出滤渣B与稀硫酸在pH=5时反应的化学方程式______________________________。
(4)工艺中还可以将滤液4进行_____________、_____________、_____________、洗涤得到含结晶水的硫酸盐晶体。
(5)MnO2常用来制取KMnO4。在一定条件下将MnO2氧化为K2MnO4,然后用铁作阴极、铂作阳极电解K2MnO4溶液得到KMnO4。电解K2MnO4溶液的总反应方程式为______________________。
试题篮
()