燃料电池能有效提高能源利用率,具有广泛的应用前景。下列物质均可用作燃料电池的燃料,其中最环保的是( )
| A. | 甲醇 | B. | 天然气 | C. | 液化石油气 | D. | 氢气 |
在常温常压下,某实验小组按下图做完实验后,实验报告记录如下。其中描述合理的是
| A.①②③ | B.②③④ | C.②⑤⑥ | D.③④⑥ |
某可充电的锂离子电池以LiMn2O4为正极,嵌入锂的碳材料为负极,含Li+导电固体为电解质。放电时的电池反应为:Li+LiMn2O4=Li2Mn2O4。下列说法正确的是( )
| A.放电时,正极反应为:Li++LiMn2O4+e-=Li2Mn2O4 |
| B.放电时,LiMn2O4发生氧化反应 |
| C.充电时,阳极反应为:Li++e-=Li |
| D.充电时,LiMn2O4发生氧化反应 |
某原电池的结构如右图所示,下列有关该原电池的说法不正确的是
| A.该电池工作时电能转变为化学能 |
| B.铁片的质量变轻 |
| C.铜片上发生的反应2H++2e-= H2↑ |
| D.SO42-向铁片移动 |
下列各反应属于原电池反应的是
| A.氧化铝膜破坏后,金属铝被迅速氧化 |
| B.锌与稀硫酸反应中加入少量CuSO4溶液,反应放出H2的速率加快 |
| C.红热的铁与水接触表面上形成蓝黑色的保护层 |
| D.铁丝在氯气中燃烧产生大量棕黄色的烟 |
如图所示,由锌片、铜片和稀硫酸溶液构成的原电池中,下列叙述正确的是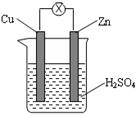
| A.锌片为负极,发生还原反应 |
| B.电流从锌片流向铜片 |
| C.一段时间后,铜片质量减轻 |
| D.一段时间后,溶液pH值变大 |
Mg-H2O2电池可用于驱动无人驾驶的潜航器。该电池以海水为电解质溶液,示意图如下。该电池工作时,下列说法正确的是
| A.Mg 电极是该电池的正极 |
| B.H2O2在石墨电极上发生氧化反应 |
| C.石墨电极附近溶液的pH 增大 |
| D.溶液中Cl-向正极移动 |
铜锌原电池(如图)工作时,下列叙述正确的是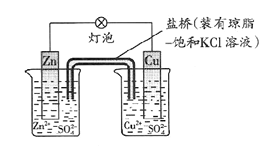
| A.一段时间后铜片增重,盐桥中K+移向CuSO4溶液 |
| B.正极反应为:Zn-2e-=Zn2+ |
| C.电子从铜片经导线流向锌片 |
| D.电池工作时Zn2+和Cu2+ 的浓度保持不变 |
下列关于电化学的理解正确的是
| A.原电池一定是负极材料失电子,发生氧化反应 |
| B.电解池的电极材料一定不参与电极反应 |
| C.原电池的负极和电解池的阳极一定发生氧化反应 |
| D.原电池中的阳离子移向负极,电解池中的阳离子则移向阴极 |
有如图所示的装置,当电流表中产生持续电流时,下列说法正确的是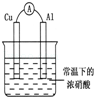
| A.Cu是原电池的负极 |
| B.Al是原电池的负极 |
| C.电子由Al沿导线流向铜 |
| D.铝片上的电极反应式为:Al﹣3e﹣═AL3+ |
某学习小组依据反应:SO2(g)+ Cl2(g)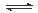 SO2Cl2(g) △H<0,设计制备磺酰氯(SO2Cl2)的装置如图甲,有关信息如表所示。
SO2Cl2(g) △H<0,设计制备磺酰氯(SO2Cl2)的装置如图甲,有关信息如表所示。
| |
SO2Cl2 |
Cl2 |
SO2 |
| 熔点/℃ |
–54.1 |
–101 |
–72.4 |
| 沸点/℃ |
69.1 |
–34.6 |
–10 |
| 性质 |
遇水发生剧烈水解 |
|
|
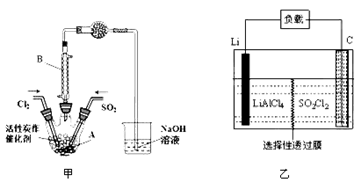
(1)若用浓盐酸与高锰酸钾为原料制取Cl2,反应的离子方程式为______________;
(2)B仪器的作用是________________;
(3)为了便于混合物的分离且提高反应物的转化率,A装置的反应条件最好选择_____。
A.冰水浴 B.常温 C.加热至69.1℃ D.沸水浴
(4)如果通入的Cl2或SO2含有水蒸气,氯气和二氧化硫可能发生反应的化学方程式为____。
(5)实验时先通入干燥的Cl2将A装置中的空气赶走,再缓慢通入干燥的SO2,即发生反应。充分反应后,继续通入Cl2使装置中的SO2进入烧杯中被吸收。分离产物后,向获得的SO2Cl2中加水,出现白雾,振荡、静置得到无色溶液W。经分析SO2Cl2与H2O反应属于非氧化还原反应,写出该反应的化学方程式___________________。
(6)GET公司开发的Li-SO2Cl2军用电池,其示意图如图乙所示,已知电池反应为:2Li+SO2Cl2 = 2LiCl+SO2,则电池工作时,正极的电极反应式为__________________。
298K时,在FeCl3酸性溶液中加少量锌粒后,Fe3+立即被还原成Fe2+。据此某学习小组设计如图所示的原电池装置。下列有关说法正确的是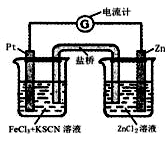
| A.正极反应为:Zn – 2e-→Zn2+ |
| B.盐桥中K+向右池移动 |
| C.Pt电极上有气泡出现 |
| D.左烧杯中溶液的红色变浅 |
试题篮
()